Раннее распознавание гормонозависимости рака предстательной железы
/ Петричко М.И., Цепелев К.А., Мартынова М.М., Антонов А.Г., Петричко Е.Г., Карпенко А.А. // Избранные вопросы судебно-медицинской экспертизы. — Хабаровск, 2003 — №6. — С. 118-125.

Кафедра урологии ДВГМУ (зав. каф. — проф. Петричко М.И.)
Актуальность проблемы
Гормонотерапия в настоящее время является основным видом лечения при местно-распространенном и диссеминированном РПЖ [2, 7, 9, 10]. Среди ее видов одним из наиболее распространенных и признанных в нашей стране является билатеральная орхэктомия [1, 2]. Однако у 15–30% больных первично выявленный РПЖ обладает гормонорезистентностью (ГРРП), что делает гормонотерапию изначально неэффективной, в связи с чем применение орхэктомии в начале лечения нецелесообразно [5,8]. На сегодняшний день нет метода, позволяющего до начала лечения распознать ГРРП. В связи с этим общепринятой является клиническая диагностика ГРРП, ведущее место в которой принадлежит оценке динамики уровня общего ПСА в крови на фоне гормоне терапии, при этом рекомендуемый минимальный срок лечения составляет 3 месяца [2,6,10]. Отсутствие снижения концентрации ПСА в крови в течение указанного срока после начала лечения более чем нa 50% указывает на низкую эффективность проводимой терапии [2,3,6]. При этом если в ходе лечения ПСА начинает возрастать, это таю <е указывает на наличие резистентности к проводимому лечению и прогрессирование опухоли [4].
Цель исследования: изучение возможностей более ранней диагностики гормонозависимыx форм рака простаты для выбора метода максимальной андрогенной блокады (МАБ) на основе и (учения динамики клинических данных в ходе лечения.
Материалы и методы исследования
В период с мая 2001 по октябрь 2002 года проведено активное наблюдение за 30 больными, получавшими гормонотерапию в режиме максимальной андрогенной блокады (МАБ), которым проведено контрольное обследование в сроки 1, 3 и 6 месяцев от начала лечения. Первая группа включала 16 больных, которые получали медикаментозную МАБ (ди- ферелин 3,75мг вм или гозерелин 3,6мг пк однократно в 28 дней и флу- тамид 250 мг 3 раза в день) в течение 6 месяцев. Вторая группа состояла из 14 больных, которым была выполнена билатеральная орхэктомия и назначен флутамид (250 мг 3 раза в день). Средний возраст больных в обеих группах был одинаков и составил 69 лет. По гистологической структуре опухолей у 28 больных имела место аденокарцинома простаты различной степени дифференцировки, число Глисона находилось в пределах от 3 до 10 (число Глисона 3–4 у 6, от 5 до 7 у 20 и от 8 до 10 у 2 больных). В одном случае имел место переходно-клеточный рак и в одном — недифференцированная форма опухоли.
Проведено наблюдение за больными в течение 6 месяцев. Контрольное обследование включало в себя: оценку качества мочеиспускания и качества жизни по системе IPSS и QL, динамику уровня общего ПСА, урофлуометрию, трансабдоминальное ультразвуковое исследование с определением объема простаты и остаточной мочи.
В ходе динамического наблюдения на основании комплексного обследования больных в динамике в сроки от 1 до 3 месяцев из группы выделена подгруппа из 6 пациентов (20%), у которых имел место гормонорезистентный процесс.
Результаты и обсуждение
Динамика основных клинико-функциональных, лабораторных и морфологических данных представлена в таблице № 1.
Таблица № 1.
Динамика основных клинико-функциональных, лабораторных и морфологических данных в целом по группе больных, получавших МАБ (N = 30, Р = 0,05)
| Показатели / Сроки лечения | IPSS (баллы) | QL (баллы) | Общий ПСА (нгмл) | Объем простаты (см3) | Объем остаточной мочи (мл) | Время мочеиспускания (сек.) | Скорость максимального потока (млсек.) |
|---|---|---|---|---|---|---|---|
До лечения | 23,6±3,3 | 4,5+0,4 | 37,4+8,7 | 71±26Д | 143±25,7 | 66+13,8 | 6,1+1,7 |
Через 1 месяц | 10,8±3,9 | 2,4±0,4 | 3,9±1,62 | 44,1+9,3 | 87±16,4 | 53+11,8 | 11,4+2,5 |
Через 3 месяца | 7,4+2,9 | 2,2*6,3 | 1,3±0,4 | 35,8+7,8 | 58±14,4 | 42±8,6 | 13,1+3,8 |
Через 6 месяцев | 6,3±2Д | 1,8+0,4 | 0,9+0,3 | 31,7+6,9 | 59+14,6 | 43+8,9 | 14,6+3,7 |
В зависимости от вида МАБ динамика основных показателей распределилась следующим образом (таблица 2).
Таблица № 2. Сравнительная оценка эффективности лечения в зависимости от вида МАБ
Сроки лечения | Показатели | 1PSS (баллы) | QL (баллы) | Общий ПСА (нгмл) | Объем простаты (см3) | Скорость максималъного потока (млсек) |
До лечения | 1 группа | 22,9+ЗЛ | 4,6±0,7 | 35±10,9 | 68,2+22,1 | 7,5+2,5 |
До лечения | 2 группа | 245+4,7 | 4,5±0,8 | 40,2+13,9 | 74,2±20,3 | 4,4±1,8 |
Через 1 месяц | 1 группа | ЮЛ ±4 Л | 2,3+0,6 | 3,6+3,7 | 42,5±9,8 | 12,3±3,0 |
Через 1 месяц | 2 группа | 11,5+4,4 | 2,5+0.5 | 4,2+2,0 | 45,8+10,2 | 10,4±4,4 |
Через 3 месяца | 1 группа | 7,5+3,1 | 2,0±0,3 | 1,2±0,6 | 34,6+8,4 | 13,7+3,9 |
Через 3 месяца | 2 группа | 7,2+2,9 | 2,4±0,3 | 1,4+0,5 | 37,2±8,4 | 12,5+3,4 |
Через б месяцев | 1 группа | 6,5+2,3' | 1,8+0,5 | 0,9±0,3 | 30,9+8,4 | 15,0+3,8 |
Через б месяцев | 2 группа | 6,7+2.4 | 1,9+0,4 | 1,1 ±0,4 | 33,1+6,6 | 14,1 ±4,1 |
- 1 группа — больные, получавшие медикаментозную МАБ.
- 2 группа — больные, получавшие МАБ (билатеральная орхэктомия + флугамид).
Независимо от способа лечения наиболее выраженный клинический эффект был отмечен в течение первого месяца у 24 (80%) больных, что проявилось в виде улучшения клинико-лабораторных показателей, качества жизни, снижения уровня общего ПСА, уменьшением объема простаты, объема остаточной мочи, увеличением эффективной емкости мочевого пузыря, скоростных показателей при урофлуометрии. В сроки от 1 до 6 месяцев изменение клинико-лабораторных и функциональных показателей было более плавным.
У 6 больных динамика клинико-лабораторных и функциональных показателей была отрицательной.
У 2 из них имели место гистологически переходно-клеточный и анапластический рак простаты. Динамика основных клинических данных у этих больных в сравнении с общей выборкой (ОВ) выглядела следующим образом. Исходно клиническое течение опухолевого процесса характеризовалось высокой агрессивностью, низким уровнем ПСА, быстрым прогрессированием заболевания. У них была 4 стадия заболевания, отмечено прогрессирование опухоли на фоне проводимой гормонотерапии (увеличение объема простаты, быстрое нарастание признаков инфравезикальной обструкции, нарастание болевого синдрома, макрогематурия, метастазирование). Оба больных умерли в сроки до 3 месяцев от начата лечения. Среди объективных методов оценки прогрессирования в двух данных случаях наиболее важное значение имели динамика объема простаты, данные урофлуометрии, качества жизни и мочеиспускания по системе IPSS и QL. Динамика уровня общего ПСА в обоих случаях не играла роли в оценке эффективности лечения.
Наши данные подтверждают данные литературы — злокачественные опухоли простаты, не относящиеся к аденокарциномам, обладают агрессивным клиническим течением, исходно обладают резистентностью к гормональному лечению, проведение данного вида терапии заведомо неэффективно [5].
У 4 больных с ГРРП исходно выявлена аденокарцинома простаты. Динамика основных показателей в различные сроки от начала лечения в этой подгруппе показана на рис. 1.2,3.
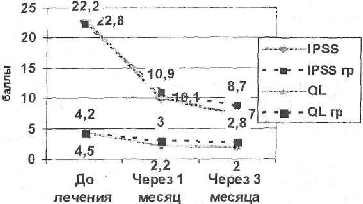
Рис. № 1. Сравнительная оценка динамики клинических данных (IPSS, QL) на фоне гормонотерапии в подгруппах гормонозависимой (N = 24) и гормонорезистентной (гр) аденокарциномы простаты (N = 4).
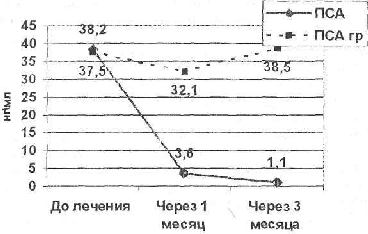
Рис. № 2. Сравнительная оценка динамики общего ПСА на фоне гормонотерапии в подгруппах гормонозависимои (N = 24) и гормонорезистентной (гр) аденокарциномой простаты (N = 4).
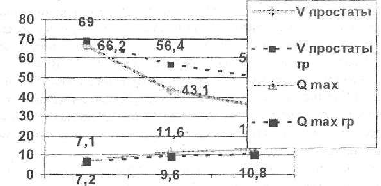
Рис. № 3. Сравнительная оценка динамики объема простаты (см3) и скорости максимального потока (млсек) на фоне гормонотерапии в подгруппах больных гормонозависимой (N = 24) и гормонорезистентной (гр) аденокарциномой простаты (N = 4).
Среди объективных клинико-лабораторных данных наибольшее практическое значение в распознавании ГРРП имела динамика уровня ПСА в крови, которая была отрицательной (у 1 человека — 25%) или слабо выраженной (у 3 человек — 75%) (не превышала 20% от исходного уровня через месяц от начала лечения) у больных при наличии гормонорезистентности. В целом в группе с ГРРП изменение ПСА характеризовалось небольшим его снижением (в среднем на 13,7%) через 1 месяц и повышением к концу 3 месяца от начала лечения (на 3,5% от исходного уровня).
Исходя из вышеизложенного, полагаем, что оценка гормоночувствительности РПЖ, на наш взгляд, возможна в большинстве случаев уже через месяц от начала лечения. Наличие у больного снижения общего ПСА более чем на 80% (отмечено у 20 человек — 66% в представленной нами группе больных) в течение первого месяца является показанием для билатеральной орхэктомии, если нет возможности дальнейшего проведения медикаментозного лечения. Это предположение подтверждается тем, что у этих больных в процессе последующего динамического наблюдения ни в одном случае не отмечено первичной гормонорезистентности. В том случае, если снижение уровня ПСА в течение первого месяца составляет менее 80%, целесообразно продолжить медикаментозное лечение с повторным обследованием больного в динамике через 3 месяца от начала лечения. Роль ПСА в оценке гормонозависимости опухоли, на наш взгляд, существенно снижается в тех случаях, когда на фоне невысокого исходного уровня общего ПСА (менее 10 нг/мл) у больных имеет место местнораспространенный или диссеминированный процесс (4 больных в представленной нами группе). В подобных случаях вопрос о хирургической кастрации, на наш взгляд, должен решаться наиболее осторожно, при более продолжительном медикаментозном лечении и активном наблюдении за больными.
Уменьшение объема простаты, как и улучшение качества мочеиспускания, имело место у всех больных с аденокарциномой как при гормоночувствительном, так и при гормонорезистентном РПЖ. Это можно объяснить поликлональным строением самой опухоли (гормонозависимые, гормоночувствительные и гормононезависимые клетки), а также наличием в тканях органа остаточного неизмененного железистого эпителия и ДГПЖ. В нашей группе больных уменьшение объема простаты в ходе гормонотерапии было более выражено у больных с гормонозависимым РПЖ (34,5% против 18,2% через месяц и 45,8% против 26,5% через 3 месяца от начала лечения), что позволяет использовать его в качестве дополнительного прогностического признака в распознавании ГРРП особенно при исходно невысоком уровне ПСА на фоне распространенного процесса. Данный вопрос требует дальнейшего изучения
Данные IPSS, QL, урофлуометрии не имели достоверной разницы (R>().7; T>Tst) в динамике этих показателей между гормонорезистентным и гормонозависимым раком простаты на фоне проводимой гормонотерапии, что возможно делает данные методы менее полезными в оценке первичной гормонорезистентности РПЖ.
Таким образом, у больных с аденокарциномой предстательной железы решение вопроса о хирургической кастрации считаем возможным только после комплексной оценки эффективности гормонотерпаии в течение 1—3 месяцев от начала медикаментозного лечения, а при наличии исходно-невысокого уровня общего ПСД и распространенного процесса — минимум через 3 месяца от начала лечения.
Выводы
- Проведение комплексной клинико-лабораторной и функциональной диагностики для оценки эффективности гормональной терапии РПЖ показывает, что независимо от вида МАБ наиболее выраженный клинический эффект наблюдался к концу первого месяца от начала лечения.
- Морфотипы опухоли простаты, не относящиеся по гистологической структуре к аденокарциномам, являются первоначально гормонорезистентными, и исходное выделение пациентов с данным типом опухолей (базально-клеточные, переходно-клеточные, анапластические, плоскоклеточные раки) является важным моментом в определении тактики лечения этих больных.
- Решение вопроса о хирургической кастрации у больных с аденокарциномами возможно только после оценки эффективности гормонотерапии в течение 1–3 месяцев от начала медикаментозного лечения.
- Оценка динамики общего ПСА играет ведущую роль в оценке гормонозависимости рака простаты. При исходно-невысоком его уровне предпочтение отдается комплексной оценке эффективности лечения, которая также включает изучение динамик и качества мочеиспускания и жизни, объема простаты, остаточной мочи, данных урофлуометрии и пальцевого ректального исследования.
похожие статьи
Случай рака кожи из клеток Меркеля: наблюдения из практики / Цекатунов Д.А., Евсеев А.Н. // Избранные вопросы судебно-медицинской экспертизы. — Хабаровск, 2022. — №21. — С. 119-121.
Патофизиологические особенности жевательного аппарата при раке толстой кишки / Иорданишвили А.К., Баринов Е.Х. // Избранные вопросы судебно-медицинской экспертизы. — Хабаровск, 2021. — №20. — С. 60-62.
Морфологическая характеристика первичной В-клеточной лимфомы сердца (случай из практики) / Волков А.В., Полетаева М.П., Эшмотова Г.К., Чупятова Е.А. // Избранные вопросы судебно-медицинской экспертизы. — Хабаровск, 2021. — №20. — С. 33-36.
Значимость «малых» клинических проявлений при «тяжелых» патологиях у детей / Русакова Т.В., Бобкова В.В., Кислов М.А. // Судебная медицина. — 2019. — №1. — С. 36-39.
Случай скоропостижной смерти при остром лейкозе / Бадяев В.В., Лазарева И.Н., Десятников К.А. // Избранные вопросы судебно-медицинской экспертизы. — Хабаровск, 2019. — №18. — С. 41-45.