Получение иммунных сывороток анти-Р, методика применения и изучение их свойств (Сообщение II)
/ Мишакова М.В. // Судебно-медицинская экспертиза. — М., 1961 — №2. — С. 35-40.

Научно-исследовательский институт судебной медицины (дир. — проф. В.И. Прозоровский) Министерства здравоохранения СССР
Поступила в редакцию 3/V 1960 г.
В 1958 г. нами были изготовлены кроличьи иммунные сыворотки анти-Р.
Задачей данной работы являлось дальнейшее усовершенствование получения иммунных сывороток анти-Р и изучение их свойств.
Получение сывороток
Опыты, проведенные в 1958 г.,, показали, что иммунизация морских свинок для получения сывороток анти-Р нецелесообразна. Поэтому для иммунизации были использованы кролики. Известно, что при выработке преципитинов новое антигенное раздражение, следующее через некоторый промежуток времени (2—3 месяца) после основного цикла иммунизации, вызывает более интенсивное образование антител. Решено было выяснить, не обнаруживается ли аналогичное явление при выработке агглютининов. С этой целью реиммунизировали, во-первых, кроликов, которые выработали антитело анти-Р достаточно высокого титра, а во-вторых, тех, которые не выработали агглютинина анти-Р после основного цикла иммунизации. Оказалось, что агглютинин анти-Р выработали лишь кролики первой партии, однако повышения титра антитела анти-Р в результате реиммунизации не произошло, напротив, титр его был несколько ниже, чем при первичной иммунизации. Таким образом, реиммунизацию проводить можно, но при этом следует использовать лишь тех кроликов, которые после первичнойиммунизации выработали антитело анти-Р достаточно высокого титра. Далее испытывали комбинированную пассивную и активную иммунизацию, предложенную Ольбрихом (Olbrich) для получения сывороток анти-N, несколько изменив ее. Кроликам вводили внутривенно 3 дня подряд по 1,5 мл специфичной иммунной сыворотки анти-Р. Затем через 7 дней следовал обычный цикл иммунизации — 6 ежедневных инъекций эритроцитов OMNP + . Ольбрих таким путем получал 100% сывороток анти-N высокого титра, хорошо поддающихся абсорбции без утраты титра. Вильдфюр (Wildfiihr) подтверждает, что этот способ дает лучшие результаты при изготовлении сывороток анти-N, однако он получил лишь 50—60% сывороток с высоким титром.
В наших же опытах из 25 кроликов, иммунизированных указанным выше методом, лишь один кролик выработал агглютинин анти-Р высокого титра. Параллельно иммунизировали 25 кроликов обычным способом, который состоял из 6 ежедневных внутривенных инъекций возрастающих доз P-положительных эритроцитов; 8 кроликов выработали антитела анти-Р. Сравнивая 2 указанных метода иммунизации, приходим к выводу, что последний метод более пригоден для получения иммунных сывороток анти-Р.
Для разрешения вопроса, существует ли различие в иммунных, свойствах агглютиногена Р, 5 кроликам вводили эритроциты с сильно- выраженным агглютиногеном Р (агглютинабильность 1:64—1:128), 5 — эритроциты с агглютиногеном Р средней силы (агглютинабильность 1:16—1:32) и 5 — эритроциты со слабовыраженным агглютиногеном Р (агглютинабильность 1:2—1:4) . В первом случае у 2 кроликов выработался агглютинин анти-Р с титром 1:32 и 1:64; во втором — у 2 кроликов образовался агглютинин анти-Р с титром 1:32 и 1:128; в третьем — у 2 кроликов выработался агглютинин анти-Р с титром 1:2 и 1:4.
Следовательно, для получения сывороток высокого титра целесообразнее применять эритроциты группы Р, агглютинабильность которых находится в пределах 1:16—1:128.
Изучение свойств сывороток
Получив сыворотки высокого титра, мы перешли к изучению их свойств. Исследования начали с подбора оптимального соотношения анти-Р и взвеси эритроцитов, тем более что в литературных источниках по этому вопросу имеются разноречивые данные [Кра и Хартер (Krah и Harter), Блюменталь (Blumenthal), Щифф (Schiff)]. К одной, двум, трем и четырем каплям сыворотки добавляли одну каплю взвеси эритроцитов. Смесь оставляли на 2 часа при комнатной температуре, затем центрифугировали в течение одной минуты и результаты реакции агглютинации учитывали под микроскопом. Оказалось, что при увеличении объема сыворотки до трех капель титр ее несколько повышается. Поэтому в дальнейшем мы пользовались всегда тремя каплями сыворотки.
Далее выясняли влияние концентрации взвеси эритроцитов на интенсивность агглютинации, так как авторы для определения агглютиногена Р предлагают различные концентрации взвеси — от 0,5 до 5%.
С этой целью к сывороткам добавляли взвесь Р-положительных эритроцитов разной концентрации и учитывали результаты реакции агглютинации после 2-часового стояния смесей при комнатной температуре и последующего центрифугирования. Установлено, что наиболее удобно применять взвесь эритроцитов в 1 и 2% концентрациях. Меньшие и большие концентрации неприемлемы вследствие получения слишком жидкой (0,5%) или густой (4 и 5%) капли, что препятствует наблюдению и может вести к ошибочным выводам. Исходя из этого, во всех последующих опытах использовалась 1—2% взвесь эритроцитов.
Известно, что при центрифугировании усиливается агглютинация эритроцитов. Кра и Хартер установили, что для наиболее точного определения фактора Р нормальной сывороткой анти-Р необходима довольно большая продолжительность реакции (около 6 часов). Применив центрифугирование в течение одной минуты, они доказали, что агглютинация может достигнуть аналогичной силы через 2 часа. Мы проверили этот факт в отношении иммунных сывороток. Для этого результаты взаимодействия сыворотки и стандартных эритроцитов проверяли через 2 часа без центрифугирования и с последующим центрифугированием, а также спустя 6 часов без центрифугирования. После 2-часового стояния ингредиентов и последующего центрифугирования агглютинация была сильнее, чем после 6-часового стояния без центрифугирования.
Затем устанавливали, возможно ли при помощи центрифугирования еще сократить продолжительность реакции. Действие сывороток проверяли эритроцитами донора с сильно выраженным агглютиногеном Р при реакции, длящейся 45 минут, 1 и 2 часа с последующим центриованием в каждом случае в течение 1, 2, 3 и 4 минут. Удлинение срока центрифугирования после контакта сыворотки и эритроцитов даже в течение 45 минут уже нередко приводит к появлению агглютинации с P-отрицательными эритроцитами, что может повлечь за. собой ошибочный вывод.
Наилучшие результаты были получены после 2-часового стояния ингредиентов при комнатной температуре и центрифугирования в течение одной минуты. Исходя из этого и учитывая, что агглютиноген Р может быть слабо выражен, мы считаем, что продолжительность реакции 2 часа является оптимальной.
Выяснялась также зависимость реакции агглютинации от температурного режима. Для этого сыворотки проверяли в отношении титра и специфичности при комнатной температуре (18—21° ), в термостате (37°) и при температуре холодильника (от 4 до 6°).
Реакция протекает одинаково хорошо при комнатной температуре и в термостате, несколько слабее при температуре холодильника (табл. 1). Следует еще отметить, что при температуре холодильника иногда (3 серии сывороток из 16) наблюдается неспецифическая агглютинация. Поэтому при такой температуре реакцию проводить небезопасно. Все наши дальнейшие опыты осуществлялись при комнатной температуре.
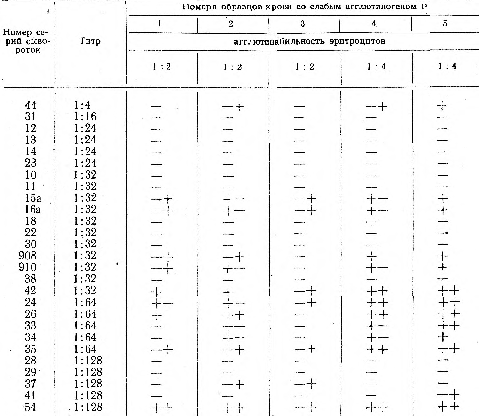
Основная трудность определения агглютиногена Р состоит в дифференцировании крови со слабо выраженным агглютиногеном Р от Р-от- рицательной крови. Ряд зарубежных авторов [Кра и Хартер, Андрезен (Andresen) и др.] считают, что, чем выше титр сыворотки, тем надежнее обеспечивается обнаружение слабо выраженного агглютиногена Р; наряду с этим они отмечают, что даже сыворотки очень высокого титра не всегда открывают такой агглютиноген. Разрешался вопрос, играет ли роль высота титра сыворотки для выявления слабовыраженного агглютиногена Р. Сыворотки 13 серий (из 27 исследованных) обнаруживали агглютиноген Р в эритроцитах с агглютинабильностью 1:2—1:4; 14 сывороток других серий его не выявляли.
Сыворотки, с которыми был получен положительный результат реакций агглютинации, имели следующий титр: одна — 1:4, пять — 1:32, пять — 1:64, две — 1:128. Титр остальных сывороток варьировал в пределах 1:16—1:128 (табл. 2).
Таким образом мы не установили зависимости между способностью сыворотки выявлять в жидкой крови слабо выраженный агглютиноген Р-я высотой ее титра [аналогичные результаты получили зарубежные авторы — Илльхманн-Крист (Illchmann-Christ) и Нагель (Nagel) в отношении сывороток анти-Р человека и свиней]. Подобное сопоставление позволяет высказать предположение, что агглютиноген Р имеет не только количественные, но и качественные различия. Возможно, что система Р при дальнейшем углубленном исследовании окажется такой же разнородной, как и система Резус.
Таблица 1
Зависимость реакции агглютинации от температурного режима
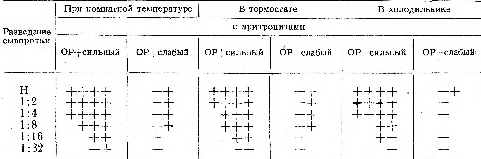
Условные обозначения; Н — неразведенная сыворотка; ++++ — реакция агглютинации, видимая макроскопически; +++ — реакция агглютинации, видимая в лупу; ++ — крупные конгломераты склеившихся эритроцитов, видимые под микроскопом; + — более мелкие конгломераты на фоне несклеившихся эритроцитов, видимые под микроскопом; -+ — слабо выраженная агглютинация, видимая под микроскопом; — — отдельные очень мелкие конгломераты, состоящие из 3—4 эритроцитов, видимые под микроскопом.
Таблица 2
Зависимость выявления слабо выраженного агглютиногена Р от титра сыворотки анти-Р
При помощи полученных сывороток было проведено исследование 826 образцов консервированной крови, полученной на Московской городской станции переливания крови и из Центрального ордена Ленина института гематологии и переливания крови. Давность крови колебалась от нескольких дней до одного месяца. В 631 случае обнаружен агглютиноген Р, в 195 — агглютиноген Р выявлен не был (табл. 3).
Таблица 3
Агглютиноген Р в крови групп О, А, В и АВ и типов М, N и MN
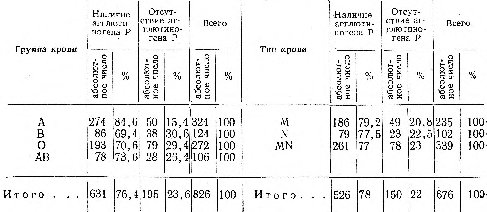
Как видно из табл. 3, в крови группы А агглютиноген Р отсутствовал реже, чем в крови групп В и 0. Что касается содержания агглютиногена Р в зависимости от системы MN, то существенных различий в его распределении в крови типов М, N и MN не отмечено.
Сыворотки четырех серий с титром 1:14—1:16 применяли в реакции абсорбции при исследовании пятен крови 12 доноров: агглютиноген Р у 3 из них был выражен сильно, у 3 — умеренно, у 3 — слабо; в крови 3 человек он отсутствовал.
В пятнах крови с сильно выраженным агглютиногеном Р, последний отчетливо (6—7 ступеней поглощения) выявлялся всеми сыворотками; при взаимодействии с пятнами крови, содержащей агглютиноген: средней силы, титр сывороток анти-Р снижался на 4—6 ступеней. Слабый агглютиноген Р с достоверностью выявить не удавалось (2—4 ступени поглощения), так как аналогичное снижение титра сывороток имело место и с P-отрицательной кровью (1—4 ступени). Повышение титра сывороток приводило к снижению показателей абсорбции. Действие сывороток двух серий, хорошо выявляющих слабо выраженный агглютиноген Р в жидкой крови, в реакции абсорбции не отличалось от действия сывороток, которые не обладали способностью обнаруживать такого рода агглютиноген в жидкой крови.
При хранении сывороток в условиях комнатной температуры было отмечено некоторое снижение их титра. В связи с этим выяснялись оптимальные условия и сроки хранения сывороток. Сыворотки сохранялись в холодильнике (от 4 до 6°), в термостате (37°), При комнатной температуре на свету и в темноте. Через месяц титр сывороток всех 9 серий, находившихся при комнатной температуре в темноте, остался на первоначальном уровне. То же относилось к сывороткам 8 серий, помещенных в термостат и в холодильник; титр сыворотки одной серии оказался сниженным на одну ступень. Содержание сывороток при комнатной температуре на свету не вызвало изменений титра сывороток, за исключением одной, титр которой снизился тоже на одну ступень.
Спустя 3 месяца наблюдалось следующее: титр одной из 9 сывороток, хранившихся при комнатной температуре в темноте, снизился на 2 ступени; на одну ступень был ослаблен титр одной сыворотки, находившейся в холодильнике; титр всех сывороток, помещенных в термостат, в той или иной мере оказался сниженным (в семи случаях на 1—2 ступени, в двух — на 3 ступени); из числа сывороток, сохранявшихся при комнатной температуре на свету у одной — титр не подвергся изменению, у семи был ослаблен на ступень одна сыворотка полностью утратила свой титр. Через 6 месяцев произошло снижение титра 7 сывороток, находившихся при комнатной температуре на свету, и утрата титра двумя сыворотками. При хранении сывороток в условиях комнатной температуры в темноте первоначальная высота титра осталась у 4 сывороток, а при содержании в термостате лишь у одной. Титр сывороток, помешенных в холодильник, претерпел наименьшие изменения (только у одной сыворотки он был незначительно — на одну ступень — ослаблен).
Поскольку снижение титра некоторых сывороток, находившихся в жидком состоянии, имеет место даже при оптимальных условиях хранения, мы попытались высушить сыворотки анти-Р двух серий. Спустя год титр обеих сывороток не изменился, но одна из них стала неспецифичной. Исследования в этом направлении продолжаются.
Исходя из указанных выше опытов, жидкие сыворотки анти-Р необходимо сохранять при температуре холодильника или в крайнем случае при комнатной температуре, но в темноте.
Выводы
- При изготовлении иммунных сывороток анти-Р следует пользоваться методом реиммунизации лишь в тех случаях, когда у кроликов выработался агглютинин анти-Р высокого титра в процессе первичной иммунизации.
- Для получения сывороток анти-Р, по-видимому, наиболее пригодным методом иммунизации является тот, который состоит из 6 ежедневных внутривенных инъекций эритроцитов в возрастающих дозах.
- В качестве материала для иммунизации целесообразно пользоваться эритроцитами, содержащими сильно или умеренно (но не слабо) выраженный агглютиноген Р.
- При проведении реакции агглютинации пробирочным методом с иммунными сыворотками анти-Р более точные результаты можно получить, соблюдая следующие условия: к 3 каплям сыворотки добавлять 1 каплю 1—2% взвеси эритроцитов, смесь оставлять на 2 часа при комнатной температуре, затем центрифугировать в течение одной минуты при 1500 оборотах, после чего учитывать результаты под микроскопом.
- Способность сыворотки анти-Р выявлять слабовыраженный агглютиноген Р в жидкой крови не зависит от высоты ее титра.
- При исследовании 826 образцов жидкой крови иммунными сыворотками анти-Р установлено, что агглютиноген Р содержится в 76,4% случаев. Наиболее высокий процент наличия агглютиногена Р (84,6) имеет место в крови группы А. Содержание агглютиногена Р в крови разных типов (М, N, MN) оказалось примерно одинаковым.
- Применение иммунных сывороток анти-Р в реакции абсорбции в количественной модификации отчетливо выявляет в пятнах крови сильно и умеренно выраженный агглютиноген Р; агглютиноген Р, выраженный слабо, обнаружить в пятнах не удается даже при помощи сывороток, отчетливо обнаруживающих этот агглютиноген в жидкой крови.
похожие статьи
Определение групповой принадлежности изолированных клеток влагалищного эпителия / Локтева Р.В., Локтев А.И., Шишкина Ж.А., Курзин Л.М. // Избранные вопросы судебно-медицинской экспертизы. — Хабаровск, 2022. — №21. — С. 78-82.
Использование методики окрашивания препаратов раствором акридинового оранжевого при определении групповой принадлежности изолированных клеток с помощью реакции смешанной агглютинации / Локтева Р.В., Королева М.В., Панасенко С.В., Курзин Л.М. // Избранные вопросы судебно-медицинской экспертизы. — Хабаровск, 2022. — №21. — С. 73-78.
Метод избирательной абсорбции при определении кровяных групп в кровяных пятнах / Серебряников П. // Судебно-медицинская экспертиза. — М.: Изд-во Наркомздрава, 1928. — №8. — С. 3-7.
Судебно-медицинские экспертизы и исследования вещественных доказательств биологического происхождения в России (по материалам 2003—2017 гг.) / Ковалев А.В., Куприна Т.А., Самоходская О.В., Кондратова И.В. // Судебно-медицинская экспертиза. — М., 2018. — №6. — С. 29-32.
Обнаружение эклипсных антигенов в трупной крови / Локтева Р.В. // Избранные вопросы судебно-медицинской экспертизы. — Хабаровск, 2019. — №18. — С. 127-131.