Обнаружение моющего средства ОП-7 при судебно-химических исследованиях биологического материала
/ Горбачева Н.А. // Судебно-медицинская экспертиза. — М., 1972 — №1. — С. 35-39.

УДК 340.67:661.185
Научно-исследовательский институт судебной медицины (дир. — проф. В.И. Прозоровский) Министерства здравоохранения СССР
Препарат ОП-7 — алкилариловый эфир полиэтиленгликоля — используется в промышленности и быту как моющее и эмульгирующее средство. Он обладает токсическим эффектом. Вопрос о доказательстве ОП-7 и его аналога ОП-10 при судебно-химических исследованиях возникает в основном в связи с отравлениями моющими средствами, а также при определении пестицидов, отдельные препараты которых содержат его в качестве эмульгатора.
Методы судебно-химического доказательства ОП-7 разработаны недостаточно. А.Ф. Баринова описала схему исследования, включающую дистилляцию с бензолом и определение отгоняющегося вещества, обнаруживающего реакции этиленгликоля. Однако аналитическую оценку методики автор не привел.
Мы разработали методику изолирования и обнаружения ОП-7 в биологическом материале (следует отметить, что она не позволяет дифференцировать ОП-7 и ОП-10).
Технический концентрат ОП-7 имеет вид мазеобразной желто-бурой массы, раствор его в воде образует пену, имеет рН 6,0—8,0. ОП-7 хорошо растворим в спирте, бензоле, хуже — в хлороформе, плохо — в этиловом эфире. Из водных и спиртовых растворов, содержащих менее 10% спирта, как показали наши опыты, он экстрагируется хлороформом и бензолом без выраженной зависимости от рН и практически не извлекается этиловым эфиром.
Изучили возможность обнаружения ОП-7 1 реакциями, связанными с наличием в молекуле как арильной, так и алкильной части.
Опыты показали, что ОП-7 можно обнаружить реакциями окрашивания: с реактивами Марки — кирпично-красное окрашивание (до 30 мкг в сухом остатке), Фреде — серовато-зеленое с розовыми разводами, при стоянии синевато-розовое окрашивание (до 40 мкг в остатке), а также пробой Витали—Морена — синее, переходящее в фиолетовое и малиновое окрашивание (до 60 мкг в остатке).
В реакциях обнаружения ОП-7 по алкильной части молекулы использовали окислительно-гидролитическое расщепление его с образованием формальдегида. Гидролиз и окисление проводили в кислой среде перйодатом калия при нагревании до 100° и под давлением. Образующийся формальдегид обнаруживали реакцией с фуксиносернистой кислотой. К 5 мл водного раствора ОП-7 в ампуле добавляли 5 капель 20% раствора серной кислоты, 10 капель 5% раствора перйодата калия в 10% растворе серной кислоты. Запаянную ампулу нагревали 1 час на кипящей водяной бане, добавляли 10 капель насыщенного раствора сернистой кислоты и 4 капли фуксиносернистой кислоты — наблюдали образование малиново-розового окрашивания.
Реакция позволяет обнаруживать до 800 мкг ОП-7 в исследуемом объеме раствора (6 мл).
Учитывая свойства ОП-7, изучили различные способы изолирования его из биологического материала. Предварительные опыты с водными растворами ОП-7 показали, что перегонка с водяным паром не пригодна для изолирования этого соединения. ОП-7 мало летуч, медленно перегоняются только продукты гидролиза соединения (или примеси препарата), дающие реакции, свойственные этиленгликолю, что подтверждает наблюдение А.Ф. Бариновой.
При изолировании по схемам Стаса—Отто и А.А. Васильевой ОП-7 переходит в кислое хлороформное извлечение. При содержании в объекте исследования больших количеств ОП-7 (1—2 г) он экстрагируется не полностью и может также извлекаться хлороформом из щелочного раствора. При относительно меньших количествах (менее 500 мг) ОП-7, как правило, полностью переходит в кислое хлороформное извлечение.
Для извлечения ОП-7 из кислого раствора использовали большие объемы хлороформа — 100, 50, 50 мл. В случае образования эмульсий их расслаивали центрифугированием (2500—3000 об/мин).
Обнаружение ОП-7 в кислом хлороформном извлечении при исследовании биологического материала с реактивами Марки, Фреде, а также реакцией Витали—Морена затруднено из-за присутствия значительного количества экстрактивных веществ, особенно при исследовании по методу Стаса—Отто. Без дополнительной очистки хлороформных извлечений обнаружить ОП-7 можно лишь в единичных случаях — при исследовании нежирных и не подвергнувшихся гнилостному разложению объектов, содержащих не менее 200—500 мг ОП-7 в 100 г объекта.
Для освобождения от сопутствующих веществ хлороформных извлечений, полученных по методу. Стаса—Отто, использовали двухступенчатую очистку: на колонке кислой неактивированной окиси алюминия и затем в тонком слое силикагеля КСК, а для очистки извлечений, полученных по методу А.А. Васильевой, — только одноступенчатую — в тонком слое силикагеля КСК.
Предварительные опыты показали, что при фильтровании гексановых растворов ОП-7 через колонку2 с 1,6—1,65 г неактивированной кислой окиси алюминия3 25—30 мг ОП-7 прочно удерживается сорбентом и не элюируется при промывании колонки 30—40 мл гексана. В присутствии экстрактивных веществ 30 мл гексана удаляют из колонки значительную часть балластных веществ (приблизительно 50% по весу остатка аликвоты исследуемого раствора, соответствующей 20 г навески). Сорбированный на колонке ОП-7 затем можно элюировать хлороформом. Для вымывания 0,5—25 мг ОП-7 необходимо пропустить через колонку 20—30 мл хлороформа. Для дальнейшей очистки от неотделенных экстрактивных веществ использовали хроматографию в тонком слое силикагеля КСК4 в 2 различающихся по полярности системах: 1) ацетон, 2) хлороформ — изобутанол (10:1). В 1-й системе ОП-7 образует пятно-полосу с Rt 0,20—0,60. При проявлении реактивом Марки полоса окрашивается в кирпично-красный цвет. Экстрактивные вещества в этой системе, продвигаясь ближе к фронту растворителя, отделяются от ОП-7. Они проявляются в виде буро-желтых пятен в области Rf 0,70 и более (см. рисунок).
Во 2-й системе ОП-7 образует пятно с «хвостом» у старта (Rt от 0 до 0,10—0,20, см. рисунок), длина «хвоста» зависит от количества ОП-7. Экстрактивные вещества, проявляемые реактивом Марки, продвигаются в верхнюю треть хроматограммы (Rf 0,65—0,75 и более) и не мешают обнаружению ОП-7. Разделение в этой системе обычно проходит более четко, чем в первой.
Методика исследования. Сухой остаток кислого хлороформного извлечения, полученный по методу Стаса—Отто, растворяли в 5 мл н-гексана и 1 мл раствора, переносили на колонку с 1,6—1,65 г неактивированной кислой окиси алюминия, предварительно пропитанную н-гексаном. Колонку промывали 30 мл гекса-на (скорость фильтрования 10—15 капель в 1 мин.), фильтрат отбрасывали. ОП-7 элюировали 30 мл хлороформа (скорость фильтрования та же). Полноту элюирования контролировали реактивом Марки (с 2—3 каплями вытекающего элюата). В случае отрицательной реакции контрольной пробы из хлороформного элюата удаляли растворитель, остаток растворяли в 0,5—1 мл хлороформа или бензола и наносили в виде пятна на хроматографическую пластинку. Хроматографировали в системе хлороформ — изобутанол (10: 1) или в ацетоне. Метчиком служил технический препарат ОП-7 (растворы в хлороформе или бензоле, 50— 60 мкг в пятне). На полученных хроматограммах ОП-7 обнаруживали реактивом Марки путем непосредственного пипетирования на слой сорбента.
Схема исследования, включающая изолирование по методу Стаса— Отто и двухступенчатую хроматографическую очистку, позволяет обнаруживать при условии применения в качестве подвижной фазы (при хроматографии в тонком слое ацетона) 50 мг ОП-7 в 100 г объекта (печень, желудок с содержимым), а при использовании второй системы (хлороформ — изобутанол, 10:1) —20 мг ОП-7 в 100 г объекта.
При исследовании по методу А.А. Васильевой для анализа объектов, не подвергавшихся глубокому гнилостному распаду (хранение при комнатной температуре 3—7 дней), применима хроматографическая очистка в тонком слое силикагеля КСК без предварительного отделения основной части балластных веществ на колонке окиси алюминия (в отличие от изолирования ОП-7 по методу Стаса—Отто). Это обусловлено большей загрязненностью остатков, получаемых при использовании метода Стаса—Отто.
Для исследования сухого остатка кислого хлороформного извлечения, полученного по методу А.А. Васильевой, его растворяли в 5 мл хлороформа или бензола, 0,1, 0,2, 0,3, 0,5 мл аликвоты раствора наносили в виде пятен на активированную пластинку силикагеля КСК и развивали ее в системе ацетон или хлороформ — изобутанол (10:1), как описано выше.
Хроматограммы ОП-7 и экстрактивных веществ (извлечение подкисленной водой) в тонком слое силикагеля КСК в системах растворителей (А) ацетон, (Б) хлороформ — изобутанол (10:1).
1 — ОП-7; 2 — экстрактивные вещества; 3 — ОП-7 в присутствии экстрактивных веществ.
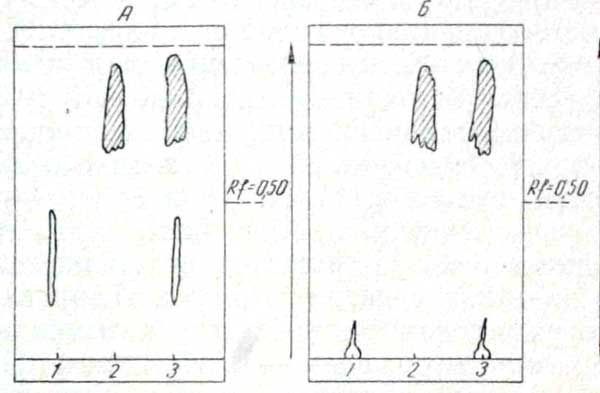
Метод А.А. Васильевой в сочетании с хроматографической очисткой и обнаружением в тонком слое силикагеля КСК позволяет при использовании 1-й системы (ацетон) обнаруживать до 10 мг ОП-7 в 100 г печени, желудка с содержимым, а при применении 2-й системы (хлороформ — изобутанол, 10:1) — до 5 мг ОП-7.
Кроме изучения поведения ОП-7 при использовании «классических» методов изолирования — перегонки с водяным паром, извлечения подкисленным спиртом и подкисленной водой, изучили возможность экстрагировать бензолом, в котором, как указывалось ранее, ОП-7 хорошо растворим. Опыты показали, что наименьшее количество соэкстрактив-ных веществ можно получать при подщелачивании объекта до рН 10,0—11,0. Извлекаемые при этом соэкстрактивные вещества четко отделяются от ОП-7 при использовании описанных выше хроматографических систем для тонкого слоя силикагеля КСК.
Методика исследования. 50 г измельченных органов подщелачивали 20% раствором щелочи до рН 10,0—11,0, заливали 50 мл бензола и взбалтывали 30 мин. на вибрационном аппарате, декантировали на фильтр, содержащий 2 г безводного сульфата натрия. Остаток в колбе вновь заливали бензолом и экстрагировали. Извлечение проводили 3 раза, экстракты объединяли, удаляли растворитель, остаток растворяли в 5 мл бензола. Аликвоты раствора 0,1, 0,2, 0,3, 0,5 мл наносили в виде пятен на пластинку активированного силикагеля КСК и хрома-тографировали в присутствии метчика, как описано выше, в системе ацетон и хлороформ — изобутанол (10:1).
Методика позволяет обнаруживать в 1-й системе 7 мг ОП-7, во 2-й — 3 мг в 100 г (печень, желудок с содержимым).
Таким образом, по чувствительности методики изолирования, очистки и обнаружения располагаются в следующем порядке: извлечение подкисленной водой (5—10 мг в 100 г объекта), бензолом (3—7 мг в 100 г объекта), подкисленным спиртом (20—50 мг ОП-7 в 100 г объекта). Эти схемы изолирования обеспечивают избирательное обнаружение ОП-7 в присутствии соэкстрактивных естественных веществ органов (печень, почки, желудок).
Наиболее полно и четко последние отделяются извлечением подкисленной водой и бензолом.
Существенной является возможность отделения токсикологически важных и лекарственных соединений, обнаруживаемых реактивом Марки — реагентом, использованным для проявления хроматограмм. При изолировании подкисленным спиртом и подкисленной водой ОП-7 переходит в кислое хлороформное извлечение, отделяясь от соединений основного характера, обычно обнаруживаемых реактивом Марки. В кислом хлороформном извлечении обнаружению ОП-7 реактивом Марки могут мешать кислые и нейтральные ароматические соединения (фенол, резорцин и др.), а также производные фенотиазина, экстрагируемые в значительной степени хлороформом из кислого раствора. Эти вещества с реактивом Марки в большинстве случаев дают окрашивания, отличающиеся от образующегося с ОП-7, но в смеси с ним они могут мешать правильной оценке результатов анализа, если в процессе исследования не будут отделены.
Изучили возможность отделения некоторых веществ, попадающих в кислое хлороформное извлечение, в системах, использованных для очистки ОП-7 от соэкстрактивных веществ. В 1-й системе (ацетон) ОП-7 (Rf 0,20—0,60) можно отделить от резорцина (Rf 0,85), а-нафтола (Rf 0,77—0,80), р-нафтола (Rf 0,78), пирокатехина (Rf 0,84), тимола (Rf 0,83—0,86), пирогаллола (Rf 0,80—0,82), фенолфталеина (Rf 0,80), аспирина (Rf 0,74—0,79), салола (Rf 0,73—0,75), фенотиазина (Rf 0,79) > а также от аминазина, мепазина, дипразина (Rf 0—0,20). Разделение перечисленных соединений зависит от соотношения их в смеси с ОП-7.
В 1-й системе не отделяется от ОП-7 салициловая кислота5 (полоса c Rf 0—0,50 в зависимости от количества).
Во 2-й системе (хлороформ — изобутанол, 10: 1) ОП-7 (Rf 0—0,10) отделяется от резорцина (Rf 0,50), а-нафтола (Rf 0,64), (5-нафтола (Rf 0,60—0,65), тимола (Rf 0,74), пирокатехина (Rf 0,61), фенола (Rf 0,75), фенолфталеина (Rf 0,75), аспирина (Rf 0,57—0,59), салола (Rf 0,75), фенотиазина (Rf 0,76), а также при некоторых соотношениях от пирогаллола (Rf 0,35). От ОП-7 не отделяется салициловая кислота (полоса с Rf 0—0,60 в зависимости от количества), аминазин, дипразин, мепазин (Rf 0—0,20).
Таким образом, предложенные для очистки ОП-7 хроматографиче-ские системы можно использовать и для идентификации его в присутствии ряда веществ, извлекаемых по общему ходу анализа хлороформом из кислого раствора.
При изолировании ОП-7 из биологического материала бензолом могут извлекаться также различные токсикологически важные вещества основного характера, проявляемые реактивом Марки, например алкалоиды опия, производные фенотиазина и др.
Однако в 1 -й системе (ацетон) ОП-7 (Rf 0,20—0,60) можно надежно отделить от наркотина (Rf 0,74) и фенотиазина (Rf 0,79), а также от морфина, героина, дионина, кодеина, апоморфина, аминазина, мепазина, дипразина, имизина (Rf в области от 0 до 0,20) и от папаверина (Rf 0,63). Четкость отделения зависит от их соотношений в смеси. В 1-й системе не отделяется от ОП-7 промедол (Rf 0—0,20).
Во 2-й системе (хлороформ — изобутанол, 10: 1) от ОП-7 (Rf 0—0,10) хорошо отделяются папаверин, наркотин, фенотйазин (Rf соответственно 0,61, 0,43, 0,76). Но в отличие от 1-й системы обнаружению ОП-7 мешают имизин, морфин, кодеин, героин, апоморфин, дионин, аминазин, дипразин и мепазин (Rf 0—0,20). В этой системе также не отделяется промедол.
Таким образом, изученные хроматографические системы, отличающиеся друг от друга по полярности, можно использовать в сочетании для дифференциации ОП-7 от различных веществ, мешающих обнаружению его реактивом Марки.
Разработанную схему, включая извлечение подкисленной водой, хроматографическую очистку и исследование в тонком слое силикагеля КСК, применили в экспертном случае (отравление этанолом с последующим приемом моющей жидкости). ОП-7 (ОП-10) обнаружили в желудке с содержимым.
В опытах по изучению сохраняемости ОП-7 к 100 г печени, почек, желудка добавляли 22 и 44 мг ОП-7. Объекты хранили в колбах, закрытых резиновыми перчатками, при температуре от 25 до —10° в течение 1 года 7 месяцев. Извлекали подкисленной водой с одноступенчатой очисткой в тонком слое силикагеля КСК и с двухступенчатой очисткой на колонке неактивированной кислой окиси алюминия и в тонком слое силикагеля КСК. При одноступенчатой очистке в 4 опытах серии проб, содержащих 44 мг ОП-7, получены четкие положительные результаты только в одной пробе; после включения первичной дополнительной очистки ОП-7 обнаружили уже в двух пробах этой серии. В пробах серий, содержавших 22 мг ОП-7, препарат не выявлен.
Полученные данные свидетельствуют о том, что при хранении биологического материала ОП-7 может разлагаться. Для исследования загнившего материала целесообразно применять схему анализа, включающую двухступенчатую хроматографическую очистку.
1 Использовали три образца технического препарата ОП-7 и один ОП-10.
2 Использовали микроколонки — стеклянные трубки — пробирки (d=7 мм, h=95— 100 мм) с отверстием в дне (d=3 мм). Колонку укрепляли с помощью пробки в широко-горлой пробирке-приемнике с отводной трубкой для вакуума. На дно колонки помещали небольшой тампон ваты, затем сорбент, просеянный через сито 0,25 мм. Колонку перед работой пропитывали гексаном.
3 Хроматографическую окись алюминия II степени активности в течение 1 часа обрабатывали 5-кратным количеством 10% раствора соляной кислоты, декантировали, осадок промывали 5—6 раз 5-кратным количеством воды, отсасывали на воронке Бюхнера, промывали дистиллированной водой до нейтральной реакции, сушили на воздухе, затем при 30° в течение 48 часов.
4 Для тонкослойной хроматографии использовали стеклянные пластинки (13Х18 см), покрытые закрепленным слоем силикагеля КСК (сито с числом отверстий 4032 в 1 см2). Пластинки готовили (из расчета на 1 см2) по прописи: силикагеля 0,0342 г, гипса 0,0017 г, воды 0,08 мл, активировали при 110° в течение 2 часов.
5 Салициловая кислота на тонком слое силикагеля КСК плохо обнаруживается реактивом Марки, но проявляется в УФ свете и раствором хлорида железа (+3).
похожие статьи
Перспективы использования параметров окислительной модификафии белков сыворотки крови для установления длительности агонального периода / Эделев И.С., Обухова Л.М., Андриянова Н.А., Эделев Н.С. // Судебная медицина. — 2019. — №3. — С. 28-32.
Обнаружение рокурония в биологических объектах методом высокоэффективной жидкостной хроматографии/масс-спектрометрии / Матвеева А.А., Федорова К.В., Лопушанская Е.М., Киреева А.В. // Судебная медицина. — 2019. — №2. — С. 49-51.
Изучение распределения неостигмина метилсульфата в организме теплокровных животных после внутрижелудочного введения / Алехина М.И., Шорманов В.К., Никитина Т.Н., Маркелова А.М. // Судебно-медицинская экспертиза. — М., 2019. — №2. — С. 40-47.
Обнаружение 25B-NBOMe — производного фенилэтиламина в биологическом материале / Барсегян С.С., Кирюшин А.Н., Ерощенко Н.Н., Туаева Н.О., Носырев А.Е., Кирилюк А.А. // Судебно-медицинская экспертиза. — М., 2019. — №2. — С. 34-39.
Особенности распределения 2,4- и 2,6-ди-трет-бутилгидроксибензола в организме теплокровных животных / Шорманов В.К., Цацуа Е.П., Асташкина А.П. // Судебно-медицинская экспертиза. — М., 2019. — №1. — С. 36-42.