Гистохимическое выявление сукцинатдегидрогеназы миокарда при воздействии токсических доз этанола и метанола
/ Дементьева Н.М. // Судебно-медицинская экспертиза. — М., 1974 — №4. — С. 12-16.

УДК 340.67:616.127-008.931:577.158]-02:615.917:[547.262 + 547.211
Кафедра судебной медицины (зав. — проф. Н.М. Дементьева) Ленинградского санитарно-гигиенического медицинского института
Мы поставили задачу выяснить особенности реакций сукцинатде-гидрогеназы (СДГ) миокарда при острой интоксикации этанолом и метанолом. Исследование проводили на 45 крысах весом 260—310 г. Животных разделили на 5 групп.
- Первой группе (10 крыс) однократно через зонд в желудок вводили токсическую дозу (3—3,5 мл) 43° этанола и через 15 мин обезглавливали.
- Второй группе (10) токсическую дозу этанола вводили дважды с интервалом в 22 ч, после чего обезглавливали через 15 мин.
- Третьей группе (10) вводили 5—5,5 мл 43° этанола. Смерть наступала от интоксикации через 10—12 ч.
- Четвертой группе (10) вводили токсическую дозу метанола (4— 4,5 мл). Смерть наступала от интоксикации через 2—3 ч.
- Пятую группу (контрольную) составили 5 интактных крыс, получавших стандартную лабораторную диету.
Кусочки миокарда исследовали гистохимически по Nachlas для выявления СДГ с помощью нитросинего тетразолия.
В целях наименьшей потери фермента кусочки замораживали в жидком азоте в течение 15 мин. Срезы толщиной 8—10 мкм изготовляли в криостате и заключали в смесь глицерина и желатина. Для обзорного исследования окрашивали гематоксилином-эозином по Маллори и Суданом III.
Спустя 7—8 мин после введения токсической дозы этанола и 4— 6 мин после введения метанола появлялись заторможенность, расстройство дыхания и координации движений, сонливость. Незадолго до смерти наступал глубокий сон, отмечались судорожное дыхание, непроизвольное отделение мочи и кала.
При вскрытии в первой группе выявлены нерезкие признаки асфиксии (жидкая кровь с небольшим количеством рыхлых свертков и слегка расширенные зрачки). Во второй группе признаки асфиксии выражались в наличии жидкой темной крови, единичных экхимозах под висцеральной плеврой и расширенных зрачках. При смерти от отравления спиртом (третья и четвертая группы) признаки асфиксии были выражены резко (полнокровие внутренних органов, темная жидкая кровь, множественные экхимозы под плеврой, эпикардом, под капсулой печени и почек).
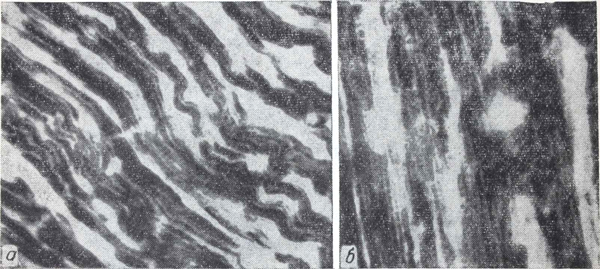
Рис. 1. Первая группа опытов.
а — линейное расположение зерен диформазана соответственно дискам (контрольные животные); б — мелкозернистое распыление и глыбчатые образования диформазана, беспорядочное расположение зерен и глыбок.
Гистохимически выявлена высокая чувствительность СДГ к воздействию токсических доз этанола и метанола. Это ее свойство отмечено также при хронической алкогольной интоксикации (В. А. Савенко, Т. Д. Полякова, 1972).
Высокая чувствительность проявляется в том, что уже через 15 мин после введения токсических доз этанола (первая группа) в миокарде изменяется величина и интенсивность окраски гранул диформазана. В большинстве волокон определялось значительное число центров дегидрогеназной активности, гранулы диформазана располагались соответственно дискам миофибрилл в виде интенсивно синих глыбок. В меньшей части мышечных волокон видны мелкозернистое распыление фермента на одних участках и крупноглыбчатые темно- и светло-синие его образования на других. Расположение фермента линейное и беспорядочное (рис. 1).
Изменение цвета зависит от состава используемой соли тетразо-лия (Е. Ф. Лушников, 1962) или от степени ферментативной активности выявляемых структур (И. Д. Шперлинг, Н. Ф. Гусакова, 1972).Линейные отложения гранул диформазана характерны для нормального миокарда (Н. А. Пробатова, 1965) и большого числа центров дегидрогеназной активности (И. Д. Шперлинг, Н. Ф. Гусакова, 1972). При минимальном числе центров дегидрогеназной активности наблюдается зернистая форма отложений. Укрупнение гранул диформазана и усиление интенсивности их окраски связывают с увеличением размеров и повышением дегидрогеназной активности митохондрий. К. М. Данилова (1969) связывает увеличение размеров гранул наряду с уменьшением их количества со снижением активности фермента, а Н. М. Чер-паченко и соавт. (1970) —с набуханием и повышенной проницаемостью митохондрий.
Придерживаясь точки зрения И. Д. Шперлинга и Н. Ф. Гусаковой (1972) при оценке полученных результатов, мы констатируем тенденцию к снижению активности фермента в волокнах миокарда при введении в организм токсических доз этанола. Эта тенденция четко выступает как при длительном воздействии этанола, так и при смерти от острой интоксикации.
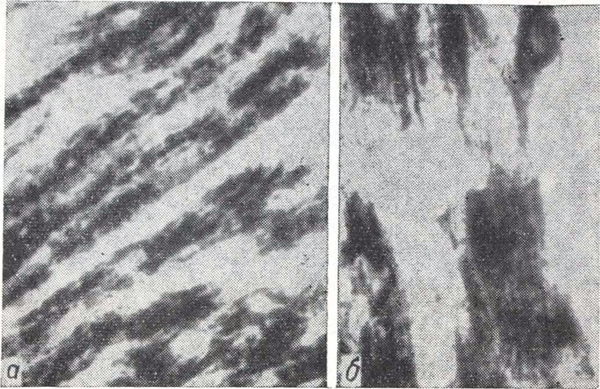
Рис. 2. Вторая группа опытов.
а — скопление глыбчатых образований с различной интенсивностью окраски диформазана и мелкозернистое распыление фермента; б — сплошная окраска саркоплазмы.
Во второй группе изменения СДГ были выражены резче. В мышечных волокнах сердца выявлены интенсивно синие очаги сплошной окраски саркоплазмы, серо-синие участки мелкозернистого распыления диформазана, скопление глыбок с различной интенсивностью окраски. Крупные глыбки чаще плотно прилегали друг к другу, образуя неправильные цепочки, реже — глыбки, значительно отстоящие друг от друга. В ряде мышечных волокон фермент не обнаруживался (рис. 2).
Сплошная окраска саркоплазмы обусловлена выходом сукцинат-дегидрогеназы из митохондрий при повышении их проницаемости, она отмечается при гипо- и аноксии миокарда в зонах некроза (Я. Л. Раппопорт и соавт., 1963; Волгарева и соавт., 1968; Е. Ф. Лушников, 1970). В. С. Жданов (1967) наблюдал гранулы диформазана различной величины и формы или сплошное окрашивание отдельных сегментов волокон при сердечной недостаточности и связывал их со структурными изменениями митохондрий. И. Д. Шперлинг и Н. Ф. Гусакова (1972) видели сплошную окраску саркоплазмы в узлах сокращения волокон и в зонах дискоидно-глыбчатого распада саркоплазмы и объясняли ее диффузией фермента из митохондрий. Во второй группе животных установлены единичные очаги дискоидного распада, резкий полиморфизм ядер, в зоне отложения липофусцина — липоиды.
Наибольшие изменения фермента наблюдали у крыс третьей и четвертой групп. При смерти от острого отравления этанолом и метано1 лом выявлено следующее: в большом числе мышечных волокон сплошное темно- и бледно-синее окрашивание саркоплазмы отдельных сегментов, беспорядочно расположенные крупные глыбки, частично слившиеся между собой, очаги мелкозернистого распыления диформазана, некоторые гранулы едва определялись из-за бледной окраски, другие резко выделялись темно-синим цветом, границы миофибрилл были нечеткие, отдельные сегменты мышечных волокон не содержали фермента (рис. 3). Только в немногих волокнах структура не отличалась от контрольных животных.
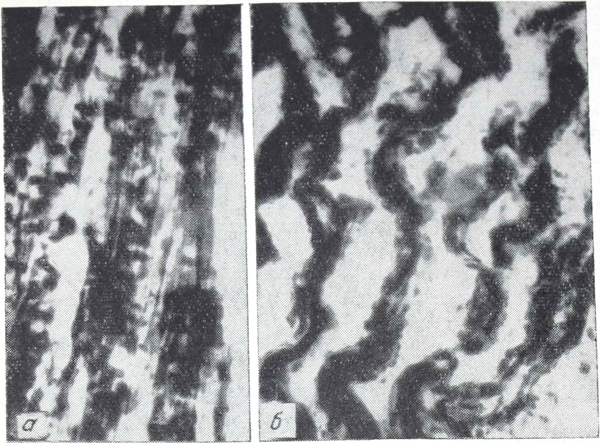
Рис. 3. Третья и четвертая группы опытов.
а— крупноглыбчатые образования диформазана, слияние глыбок и беспорядочное их расположение; б — сплошное окрашивание саркоплазмы; в — зернистое распыление и глыбчатые образования диформазана (острое отравление).

Рис. 3. Третья и четвертая группы
опытов.
а — крупноглыбчатые
образования диформазана,
слияние глыбок и
беспорядочное их расположение;
б — сплошное окрашивание
саркоплазмы;
в — зернистое распыление и
глыбчатые образования
диформазана (острое
отравление).
Выявлены мелкие очаги дискоидного распада, полиморфизм ядер, начальные стадии липоидной инфильтрации некоторых волокон.
У контрольных животных в большинстве мышечных волокон определялись интенсивно синие зерна диформазана одинакового размера, равномерно расположенные по ходу миофибрилл. Лишь в немногих волокнах они распределялись неравномерно в виде очагов и распыления.
Такое расположение гранул было преимущественно в области вставочных пластинок.
Интенсивно синий цвет зерен диформазана без их структурных изменений оценивается как проявление повышенной активности СДГ. У декапитированных животных оно обусловлено способностью миокарда довольно долго переживать общую смерть организма.
Выводы
- СДГ высокочувствительна к токсическим дозам этанола и метанола. Уже через 15 мин после введения спирта в желудок в миокарде возникают качественные изменения фермента, достигающие максимума при развитии смертельной алкогольной интоксикации.
- В миокарде можно выявить ранние изменения, которые могут вызвать функциональные расстройства деятельности сердца и смерть.
- Энзимогистохимическое исследование имеет значение для понимания генеза наступления смерти при острой алкогольной интоксикации, особенно при отсутствии морфологических изменений.
похожие статьи
Морфологические маркеры функциональной активности печени при алкогольной интоксикации / Морозов Ю.Е., Породенко В.А., Травенко Е.Н., Горностаев Д.В. // Судебно-медицинская экспертиза. — М., 2019. — №3. — С. 37-41.
Алкоголь-ассоциированные причины смерти и посмертная этанолемия / Чижикова И.О., Шигеев С.В. // Избранные вопросы судебно-медицинской экспертизы. — Хабаровск, 2021. — №20. — С. 144-147.
Суицидальное отравление чистящим средством для унитазов / Бушманн К., Хартвиг С., Тсокос М. // Судебная медицина. — 2019. — №3. — С. 39-41.
Случай смерти от отравления этиленгликолем / Збруева Ю.В., Кабакова С.С., Засыпкина Т.В., Лазарева А.Ю., Даниличева Н.В., Богомолов Д.В. // Избранные вопросы судебно-медицинской экспертизы. — Хабаровск, 2019. — №18. — С. 85-87.
Оценка морфофункционального состояния печени морфометрическими методами исследования / Травенко Е.Н., Породенко В.А. // Судебная медицина. — 2019. — №3. — С. 19-23.
Атлас по судебно-медицинской гистологии / Пиголкин Ю.И., Кислов М.А., Должанский О.В., Филиппенкова Е.И., Крупин К.Н. — 2021.