Судебно-химическое исследование трупного материала методом хроматографии в тонком слое сорбента при отравлении лекарственными веществами кислого, нейтрального и основного характера
/ Краснова Р.Р., Артамонова З.Н., Путиева Г.М. // Мат. VI Всеросс. съезда судебных медиков. — М.-Тюмень, 2005.

(Московская область)
Применяемые в настоящее время систематические методы изолирования токсикологически важных веществ из тканей внутренних органов подкисленным спиртом и подкисленной водой [1,2] /Методы Стасс-Отто и А.А. Васильевой, предложенные еще в середине 19 и 20 веков для исследования методами «мокрой химии»/, имеют ряд существенных недостатков: они являются малочувствительными к ряду лекарственных соединений, не обеспечивают достаточной степени очистки, длительны, требуют большого количества биологического материала (навески органов по 100г.), больших объемов высокотоксичных органических растворителей, опасных для здоровья сотрудников и загрязняющих окружающую среду. Применяемая для дальнейшего исследования высокочувствительная хроматография в тонком слое сорбента, позволяет использовать меньшие аликвоты органического экстракта из внутренних органов [3].
В настоящее время в литературе по химико-токсикологическому анализу опубликовано большое количество работ по изолированию лекарственных веществ из тканей органов с использованием малых навесок. Основное внимание исследователи акцентируют на анализе мочи, крови [7,8,9,10,11,12].
В современном токсигологическом анализе предпочтение отдается процедурам, позволяющим экстрагировать максимальное количество веществ и их метаболитов, по–возможности, в чистом виде, расходуя минимальное количество дорогостоящих и опасных для здоровья растворителей, с наибольшим выходом и наименьшими затратами времени. С появлением инструментального анализа отпала необходимость в 2-х литровых делительных воронках, больших объемах растворителей и фракционных разделениях. Появилась возможность использовать однократную экстракцию без разделения на фракции, расходуя значительно меньшие объемы растворителей и меньшие по весу пробы.
Цель нашего исследования – изучить методику использования малых навесок тканей внутренних органов с последующим проведением ТСХ-скрининга при судебно-химическом и токсикологическом исследовании на наличие неизвестных веществ кислого, основного и нейтрального характера.
Методика состоит из пробоподготовки, жидкость-жидкостной экстракции и хроматографии в тонком слое сорбента.
Метод тонкослойной хроматографии (ТСХ), как метод идентификации при систематическом ходе анализа, являющийся одним из основных методов исследования лекарственных соединений, не потерял своего значения за качества, определяющих его востребованность в практических судебно-химических лабораториях, за его простоту, наглядность и доступность по стоимости оборудования и реактивов. Методическая и приборная база этого метода позволяет автоматизировать и стандартизировать условия проведения исследований для получения воспроизводимых результатов. Использование химических реактивов, селективных для наркотических, психотропных и сильнодействующих веществ, резко повышает надежность их идентификации. При судебно-химических исследованиях тонкослойная хроматография применяется для проведения скрининговых (поисковых) исследований токсикологических веществ неизвестной природы и для исследований на конкретное средство или вещество (кислого, нейтрального и основного характера), подтверждающих или отрицающих их присутствие в исследуемом объекте.
Метод основан на разделении лекарственных веществ в тонком слое сорбента с последующим выявлением (детектированием), экспонированием в УФ свете, проведением реакций окрашивания и измерением величин Rf.
Экспериментальная часть
Оборудование и материалы
Пробоподготовка проводилась с использованием новейшего оборудования: весы электронные с ценой деления 0,1 г и 1 мг; измельчитель органов – блендер; рН–метры; центрифуги на 3-4-9 тысяч об/мин; аппараты для встряхивания жидкостей в сосудах, пробирках - шейкеры, вортекс; концентратор для выпаривания жидкостей в токе воздуха; дозаторы одноканальные от 5 мкл до 1000 мкл. и т.д.
Для хроматографии в тонком слое сорбента применялись хроматографические пластинки «Сорбфил» ПТСХ – П-А- УФ, сорбент СТК - 1А, зернение 5-17 мкм, толщина слоя 110 ммк, размером 10 х 15 см; УФ облучатели с длиной волны 254 и 366 нм и т.д.
Объекты исследования. Работа проводилась на модельных образцах из ткани печени, умерших вследствие травмы и предварительно проверенные на отсутствие лекарственных веществ. Параллельно исследовался и экспертный материал.
Стандартные растворы. Стандартные этанольные растворы лекарственных веществ 2 мг/мл готовили весовым методом из стандартных субстанций лекарственных веществ. Из стандартных растворов готовили рабочие растворы различной концентрации.
Исследование модельных образцов
Разработку методики пробоподготовки тканей внутренних органов (малой размерности проб) для последующего анализа проводили на модельных образцах печени [7,10].
Группа исследуемых соединений (амитриптилин, анаприлин, верапамил, диазепам, димедрол, но-шпа, лепонекс, клозапин, тизерцин, аминазин, фенобарбитал) выбрана с учетом наиболее часто встречающихся при судебно-химических исследованиях.
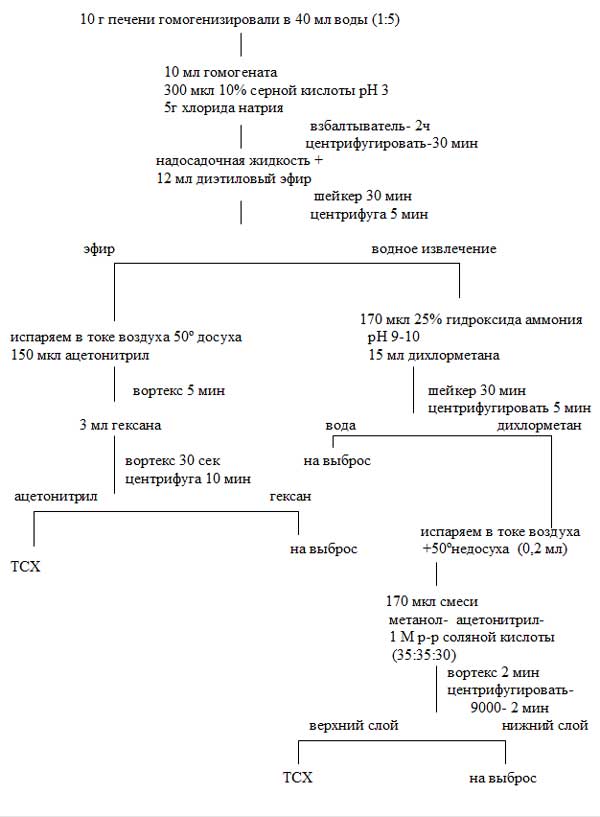
Ткань печени (10 г) гомогенизировали в 40 мл дистиллированной воды с помощью блендера. Получили разведение 1:5.
К 10 мл полученного гомогената, добавляли по 100 мкл растворов лекарственных веществ (указанных выше) различной концентрации (токсическая и летальная дозы) [7,8,9], тщательно перемешивали и оставляли на 15 часов, во всех случаях параллельно исследовали пробы печени без лекарственных веществ (контроль отрицательный).
Затем добавляли 300 мкл 10 % раствора серной кислоты до рН 3 (контроль рН-метр) и 5 г хлорида натрия, настаивали при комнатной температуре на аппарате для встряхивания.
Смесь центрифугировали в течение 30 минут при 3000 об/мин. Надосадочную жидкость сливали, исправляли значение рН в случае необходимости, рН 3 (контроль рН- метр).
Оставшиеся 40 мл гомогената можно использовать при необходимости для дополнительного расширения исследования, для повторных исследований, для дубликата и для количественного определения найденного вещества хроматографическим методом с внутренним стандартом.
Экстракция веществ кислого и нейтрального характера.
Водное извлечение экстрагировали 12 мл диэтилового эфира в течение 30 минут на шейкере, центрифугировали в течение 5 минут при 4000 об/мин. Переносили эфир в пробирку емкостью 10 мл. Испаряли эфир в концентраторе, в токе воздуха, при температуре 50° С досуха. К остатку в пробирке добавляли 150 мкл ацетонитрила, встряхивали пробирку в течение 5 мин на вибрационном смешивателе вортекс, добавляли 3 мл гексана (для очистки), встряхивали пробирку в течение 30 сек. на вортекс и центрифугировали в течение 10 минут при 4000 об/мин. Удаляли верхний слой (гексан) с помощью водоструйного насоса - на выброс (рис.1). Далее органический слой сконцентрировали и исследовали методом хроматографии в тонком слое сорбента на ТСХ-пластинках . На пластинки наносили по 10 мкл полученного экстракта в виде пятен (диаметр пятна не превышал 3 мм). Для выявления веществ кислого и нейтрального характера, в качестве свидетелей наносили по 2 мкг смеси стандартных веществ.
ТСХ системы для веществ кислого и нейтрального характера.
- - система – 1 хлороформ-н-бутанол-25% раствор гидроксида аммония 70:40:5.
- - система – 2 хлороформ – ацетон 9:1.
Сначала влажные пластинки экспонировали в УФ свете при 366 нм и 254 нм, отмечали флюоресценцию и окраску пятен.
Пластинки проявляли в следующем порядке:
- Одну пластинку последовательно - раствором дифенилкарбазона, через 2-3 мин раствором сульфата окиси ртути (производные барбитуровой кислоты).
- Вторую - раствором ТМВ (5 % раствор тетраметилбензидина) – сначала пластинку помещали в хроматографическую камеру, затем в камеру помещали стаканчик с 5-10 мл 10 % раствора соляной кислоты, в него же добавляли 5-10 мл 1,5 % раствора перманганата калия и камеру плотно закрывали крышкой. Пластинка в камере находилась с атмосфере хлора в течение 15-20 мин., затем пластину вынимали, давали улетучиться избытку хлора. Экспонировали в УФ свете при 366 нм, отмечали флюоресценцию и окраску пятен. Затем опрыскивали ТМВ реактивом и снова экспонировали в УФ свете при 366 нм (производные барбитуровой кислоты, производные 1,4 бензодиазепина) [4].
- Третью - последовательно 5 % раствором хлорида окисного железа, затем реактивом Драгендорфа. (салицилаты, азотсодержащие вещества).
Экстракция веществ основного и нейтрального характера
К водной фазе, оставшейся после извлечения эфиром, добавили 170 мкл 25% раствора гидроксида аммония рН – 9-10, 15 мл дихлорметана (использование хлороформа – избегали из-за его высокой токсичности и канцерогенности) и экстрагировали на шейкере в течение 30 минут. Центрифугировали при 4000 об/мин 5 минут. Отбирали верхнюю водную фазу на выброс при помощи водоструйного насоса. Органическую фазу выпаривали в концентраторе, в токе воздуха, около 30 минут при температуре 50°С не досуха. К остатку (не сухому) добавили 170 мкл смеси метанол – ацетонитрил – 1М раствор соляной кислоты (35:35:30) и встряхивали на на вибрационном смешивателе вортекс – 2 мин (при исследовании мочи добавить 170 мкл смеси метанол – ацетонитрил – 1М раствор соляной кислоты (30:30:40).
Жидкость из пробирки полностью перенесли пипеткой с удлинённым наконечником в узкую Эппендорфовскую пробирку емкостью 0,5 мл с пробочкой. Центрифугировали при 9000 об/мин в течение 2 минут (рис.1). Верхний слой наносили по 10 мкл в виде пятен (диаметр пятна не превышал 3 мм) на ТСХ - пластинки. В качестве свидетелей наносили по 2 мкг в пятно смесей стандартных лекарственных веществ, для которых в процессе проведения исследования был определен предел обнаружения, он составил от 1-3 мкг в пятне.
Пластинки хроматографировали в подобранной нами системе. Выбраны оптимальные соотношения растворителей позволяющие использовать ее одну для хроматографирования большого количества веществ основного и нейтрального характера. Система обеспечивает разделение лекарственных веществ и отсутствие существенных помех со стороны соэкстрактивных веществ из печени.
Эндогенные вещества дифференцировавали от экзогенных веществ нанесением на одну пластинку серий проб экстрактов из одноименных объектов – например печени; или почек, или содержимого желудка, или мочи.
ТСХ – система для веществ основного и нейтрального характера ацетон-толуол-96°этиловый спирт-25% раствор гидроксида аммония 45:45:4:3.
Для детектирования пластинок использовали разные реагенты, позволяющие дифференцировать вещества, даже в случае если их величины Rf близки или совпадают.
- Одну пластинку – последовательно опрыскивали реактивом хлорида окисного железа, экспонировали в УФ свете 5-15 мин при 254 и 366 нм, отмечали флюоресценцию и окраску пятен и величину Rf. Тщательно высушивали пластинку, затем проявляли реактивом Драгендорфа (азотсодержащие вещества).
- Вторую - пипетировали реактивом Марки пастеровской пипеткой сверху вниз, отмечали окрашивания пятен и величины Rf, экспонировали в УФ свете (наркотические вещества опийной группы, производные фенотиазина и др.).
- Третью - влажную пластинку экспонировали в УФ свете при 366 нм, высушивали и проявляли реактивом FBK (соли черного прочного К), затем - 0,5 М раствором оксида натрия. (производные амфетамина, фенилалкиламина) [5].
- Четвертую - проявляли смесью 96˚ этанола и 50% раствора серной кислоты в соотношении 1:1 (производные фенотиазина).
Для каждой пластинки в качестве свидетелей использовали свою собственную стандартную тестовую смесь лекарственных веществ, которая дает окрашенные пятна с данным реагентом.
При необходимости возможно расширение ТСХ исследования в других системах растворителей, с детектированием другими хромогенными реагентами.
Исследование экспертного материала
При исследовании экспертного материала использовали отработанную на модельных опытах методику, указанную выше. Объектами исследования являются различные ткани внутренних органов, содержимое желудка и моча.
Обсуждение и результаты
В процессе работы на модельных объектах описали методику пробоподготовки для малых навесок внутренних органов, с последующей житкость-житкостной экстракцией и ТСХ скринингом веществ кислого, основного и нейтрального характера. Применение этой методики позволяет использовать однократную экстракцию расходуя значительно меньшие объемы растворителей и реагентов, существенно сокращает время анализа. Наличие новейшего лабораторного оборудования позволяет производить серийные исследования и получать воспроизводимые результаты.
Установлено, что извлечения из малых навесок тканей внутренних органов по предложенной методике, получаются достаточно чистые; пятна искомых веществ на ТСХ пластинах чёткие, в предложенной системе хорошо отделяются от соэкстрактивных эндогенных веществ. Показано, что на пластинки «Сорбфилл» в виде пятна 3 мту экстракта эквивалентную не более 0,5г печени (почки или др.).
Использование единой системы для хроматографирования веществ основного и нейтрального характера, позволяет сохранить постоянные величины Rf лекарственных веществ, что значительно облегчает поиск и идентификацию их при последовательном проявлении пластинок разными хромагенными реагентами и УФ облучении.
Замечено, что при нанесении на хроматографическую пластинку экстрактов из одноименных органов (печеней или почек и др.), после хроматографирования и детектирования соэкстрактивные вещества располагаются линейно, что значительно облегчает визуальную идентификацию веществ.
Таким образом, ТСХ скрининг «неизвестных веществ» позволяет обнаружить или исключить токсикологически-важные вещества кислого, нейтрального и основного характера. Отсутствие пятен после детектирования в УФ свете и хромогенными реактивами имеет отрицательное значение
Полученные этим методом экстракты из внутренних органов можно использовать для подтверждающих инструментальных исследований с помощью ГХ, ГХМС, ВЭЖХ и количественного определения при положительном результате ТСХ скрининга.
При невозможности применения подтверждающих инструментальных методов, проводится дополнительное исследование в тонком слое сорбента с использованием альтернативных систем растворителей и реагентов для обнаружения и идентификации найденных веществ.
В процессе работы были определены предел обнаружения и процент выхода изолируемых веществ. Предел обнаружения для веществ кислого характера составил 2 мкг в пятне; для веществ основного характера от 1 до 3 мкг в пятне. Степень извлечения предложенным методом составляет 50- 60% (определяли методом ВЭЖХ).
Выводы:
- 1) Описан метод изолирования подкисленной водой из малых навесок тканей внутренних органов житкость-житкостной экстракцией для ТСХ-скрининга (обнаружения) лекарственных веществ кислого, нейтрального и основного характера.
- 2) Использование современного лабораторного оборудования для пробоподготовки и экстракции, описанным методом, позволяет проводить серийные исследования, сократить время анализа и получать воспроизводимые результаты.
- 3) Метод позволяет экстрагировать максимальное количество веществ и их метаболитов, расходуя минимальное количество дорогостоящих реагентов и растворителей.
- 4) Оставшийся гомогенат (40мл из 50) при необходимости можно использовать для дополнительного исследования – повторить, расширить исследование для направленного анализа и для количественного определения найденного вещества хроматографическими методами с внутренним стандартом.
Рис.1. Схема экстракции кислых, основных и нейтральных веществ из биологического материала
похожие статьи
Перспективы использования параметров окислительной модификафии белков сыворотки крови для установления длительности агонального периода / Эделев И.С., Обухова Л.М., Андриянова Н.А., Эделев Н.С. // Судебная медицина. — 2019. — №3. — С. 28-32.
Обнаружение рокурония в биологических объектах методом высокоэффективной жидкостной хроматографии/масс-спектрометрии / Матвеева А.А., Федорова К.В., Лопушанская Е.М., Киреева А.В. // Судебная медицина. — 2019. — №2. — С. 49-51.
Изучение распределения неостигмина метилсульфата в организме теплокровных животных после внутрижелудочного введения / Алехина М.И., Шорманов В.К., Никитина Т.Н., Маркелова А.М. // Судебно-медицинская экспертиза. — М., 2019. — №2. — С. 40-47.
Обнаружение 25B-NBOMe — производного фенилэтиламина в биологическом материале / Барсегян С.С., Кирюшин А.Н., Ерощенко Н.Н., Туаева Н.О., Носырев А.Е., Кирилюк А.А. // Судебно-медицинская экспертиза. — М., 2019. — №2. — С. 34-39.
Особенности распределения 2,4- и 2,6-ди-трет-бутилгидроксибензола в организме теплокровных животных / Шорманов В.К., Цацуа Е.П., Асташкина А.П. // Судебно-медицинская экспертиза. — М., 2019. — №1. — С. 36-42.