Применение твердофазной экстракции при исследовании производных бензодиазепина в биологических объектах на примере феназепама
/ Крупина Н.А., Гущенко А.В., Пашовкина Р.Н., Краснова Р.Р., Калетина Н.И. // Мат. VI Всеросс. съезда судебных медиков. — М.-Тюмень, 2005.

(Московская область)
В период внедрения современного оборудования в лабораториях, проводящих судебно-химические и химико-токсикологические исследования, большое значение придаётся вопросам, связанным с пробоподготовкой биообъектов. На сегодняшний день основным методом пробоподготовки при анализе на лекарственные и наркотические вещества в биопробах является жидкость-жидкостная экстракция. Наряду с достоинствами этот метод имеет ряд недостатков, таких как, длительность проведения в серийных исследованиях, соэкстрагирование большого количества мешающих веществ, невысокая эффективность извлечения, и т.д. Известен альтернативный метод пробоподготовки, давно зарекомендовавший себя в других химических исследованиях – твердофазная экстракция (ТФЭ). Преимущества этого метода пробоподготовки следующие [10]:
- простота в использовании,
- сокращение времени при проведении серийных анализов,
- получение высококачественных извлечений,
- понижение шумового хроматографического фона,
- хорошая воспроизводимость,
- возможность экстрагирования широкого круга веществ.
Основной целью нашего исследования являлось изучение возможности использования выбранных нами патронов AccuBOND для проведения процедуры твердофазной экстракции производных бензодиазепина из биожидкостей (кровь и моча) и дальнейшего анализа методами газо-жидкостной хроматографии.
Для построения метода анализа биообъектов в качестве модели исследования был выбран феназепам. Выбор обусловлен тем, что этот препарат довольно часто встречается в практике судебно-химического отдела (СХО) ГУ Бюро судебно-медицинской экспертизы МЗ МО.
В 2004г. из 36 экспертиз биообъектов трупного материала, в которых были обнаружены производные бензодиазепина, феназепам встретился в 11 случаях (рис.1). Из 71 исследования, присланного для анализа по направлению больниц и наркологических диспансеров (биообъекты от живых лиц), в которых было подтверждено наличие производных бензодиазепина, феназепам найден в 38 случаях (рис.2).
 | 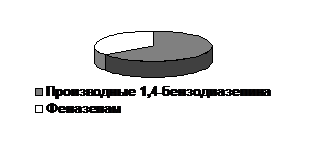 |
Рис.1. Экспертизы трупного материала, в которых обнаружен феназепам, от общего количества положительных случаев на производные бензодиазепина. | Рис.2. Экспертизы биожидкостей от живых лиц, в которых был обнаружен феназепам, от общего количества положительных случаев на произодные бензодиазепина. |
Перед нами были поставлены следующие задачи: подобрать оптимальный метод пробоподготовки мочи с использованием патронов AccuBOND для ТФЭ и рассмотреть возможность использования ТФЭ для количественного определения феназепама в крови и сыворотке методом высоко эффективной жидкостной хроматографии с диодно-матричным детектором.
Твердофазная экстракция
ТФЭ представляет собой процесс сорбции исследуемого вещества и примесей, содержащихся в матрице, на сорбенте [6],[4]. Разделение при этом происходит за счет различного сродства компонентов разделяемого раствора к сорбенту и элюирующему растворителю, а также благодаря возможности использования ступенчатого элюирования. Сорбированные компоненты смываются растворителями, отличными по полярности от матрицы. Стадии ТФЭ [8]:
- 1-кондиционирование - подготовка ТФЭ картриджа к взаимодействию с пробой;
- 2-загрузка образца - интересующие компоненты сорбируются на поверхности твердой фазы;
- 3-промывка - удаление ненужных компонентов пробы;
- 4-элюирование - селективная десорбция и сбор интересующих компонентов.
Твердофазная экстракция осуществляется при помощи вакуумной установки. Селективность проведения ТФЭ достигается подбором картриджа с соответствующей фазой.
На российском рынке представлены картриджи, которые отличаются
- по разновидности неподвижной фазы:
- гидрофобные, неполярные,
- гидрофильные, полярные,
- ионообменные: анионообменные, катионообменные,
- ковалентные,
- анионообменные сополимерные,
- катионообменные сополимерные,
- сополимерные связанные фазы.
В общем случае разделение компонентов может происходить тремя различными путями [2]:
- примеси и все мешающие компоненты удерживаются на патроне, а определяемые проходят через него,
- мешающие компоненты проходят через патрон, а определяемый компонент сорбируется на патроне, после чего элюируется более полярным растворителем,
- определяемые и мешающие компоненты сорбируются на патроне, после чего могут фракционироваться за счет применения ступенчатого элюирования (изменение рН, ионной силы элюирующего растворителя).
В своем исследовании мы использовали картриджи AccuBOND ODS C18 200, ODS C18 500 и EVIDEX 200 (Agilent Technologies) с гидрофобной неполярной фазой C18 (октадецилсилан) (рис.3).
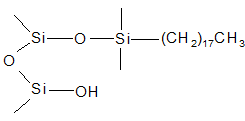
Рис.3. Структура октадецилсилана, ковалентно связанного с поверхностью силикагелевых частиц.
Фаза C18 эффективна и универсальна для изолирования соединений с различной химической структурой.
Экспериментальная часть
В табл. 1 представлены основные характеристики используемых нами патронов [7]
Таблица 1
Основные характеристики патронов AccuBOND
Основные характеристики патронов | ODS C18 |
ODS C18 | EVIDEX (C18) |
Количество сорбента | 200 мг |
500 мг | 200 мг |
Максимальный объем патрона | 3 мл |
3 мл | 3 мл |
Площадь поверхности силикагеля | 546 м2/г |
546 м2/г
| 546 м2/г |
Средний размер пор силикагеля | 60 Ǻ |
60 Ǻ | 60 Ǻ |
Значение pH | 7 |
7 | 7 |
Содержание углерода |
19,0% | 18,5% |
11,8% |
Площадь, приходящаяся на одну частицу |
1,6 мкмоль/м2 |
1,6 мкмоль/м2 | 2,6 мкмоль/м2 |
Способность к обмену | не проанализирована |
не проанализирована | 0,09 ммоль/г |
Форма частиц | неправильная |
неправильная | неправильная |
Средний размер частицы (мкм) | 57 |
55
|
59 |
Процент частиц <10 мкм |
0,01 | 0,01
| 0,03 |
Процент частиц <25 мкм | 1,73 |
2,30
|
1,34 |
Процент частиц >90 мкм |
5,87 | 5,60 |
9,30 |
Объекты исследования: цельная кровь, сыворотка, моча. В качестве контроля использовали бланковые плазму и мочу (не содержащую лекарственных веществ).
Стандарты и реактивы: растворы феназепама в метаноле 1,2,4,6,10,20 мг/л; раствор дифениламина 20 мг/л (внутренний стандарт ХМС), раствор 5-метилфенил-5-фенилгидантоина 10 мг/л (MPPH) (внутренний стандарт ВЭЖХ); метанол; 50% раствор метанола; 5% раствор метанола; этилацетат; бутилацет; 1М трис-гидроксиметил-аминометан (трис-буфер); N,O-бис-триметилсилил-трифторацетамид +1% триметилхлорсилан (БСТФА + 1% ТМС) (реагент для дериватизации).
Методы исследования
Качественный и количественный анализы биообъектов проводили методами хромато-масс-спектрометрии и высоко эффективной жидкостной хроматографии.
1. Метод хромато-масс-спектрометрии (ХМС).
Для улучшения хроматографических свойств производных бензодиазепина, в том числе феназепама, использовали процедуру дериватизации [9]. В качестве дериватизирующего реагента нами был выбран БСТФА + 1% ТМС (силилирующий реагент) [3] . Процедуру проводили в герметически закрывающихся виалах, к сухому остатку извлечения после проведения ТФЭ или ЖЖЭ добавляли 100 мкл реагента, герметично закрывали и нагревали при 70˚С в термоблоке 20 мин. Исследование проводилось на хромато-масс-спектрометре с хроматографом Agilent Technologies 6890N и масс-селективным детектором Agilent Technologies 5973N в режиме сканирования индивидуальных ионов [5]: Колонка хроматографа кварцевая, капиллярная HP-5ms (30м х 0,25мм х 0,25нм) (5% фенилметилполисилоксановая фаза). Начальная температура колонки-700С. Время выдержки при начальной температуре-1 минута. Подъем температуры в диапазоне 70-2800С-200С/мин. Скорость газа носителя (гелий)-1 мл/мин. Температуры инжектора, источника и квадруполя-2800С, 2300С и 1500С соответственно. Объем вводимой пробы-1 мкл. Диапазон масс-39-500 а.е.м.
Осуществляли мониторинг ионных масс (m/z): 422, 420, 385 и 73 для силилированного производного феназепама (феназепам ТМС) и 169, 168 – для дифениламина, используемого в качестве внутреннего стандарта.
Нами была проведена оценка ТФЭ на различных модификациях патронов пяти тестовых контрольных образцов мочи с концентрацией 1 мг/л феназепама в каждом и сравнение с результатами, полученными при жидкость-жидкостной экстракции.
Процедура проведения ТФЭ тестовых контрольных образцов мочи представлена в таблице 2:
Таблица 2
Процедура проведения ТФЭ тестовых контрольных образцов
Стадии ТФЭ |
Патроны для ТФЭ | |||||||||
ODS C18 500 |
ODS C18 200 | EVI DEX 200 |
ODS C18 200 | EVI DEX 200 |
ODS C18 500 | ODS C18 200 |
EVI DEX 200 | ODS C18 200 |
ODS C18 200 | |
Кондиционирование |
раствор метанола в воде (1:1) – 1 мл | |||||||||
Загрузка образца |
1 мл мочи, 50 мкл раствора дифениламина (ДФА) 20 мг/л (внутренний стандарт) + 50 мкл раствора феназепама 20 мг/л | |||||||||
Промывка | 5% раствор метанола - 1 мл | |||||||||
Элюирование* | бутилацетат - 1 мл | |||||||||
Подтвержметод анализа |
ГХ-МС
| |||||||||
* Сравнивали элюирующие способности метанола, бутилацетата, этилацетата
По результатам интенсивностей пиков, полученных методом ХМС, контрольных образцов мочи с концентрацией феназепама 1 мг/л с использованием бутилацетата составлена диаграмма (рис. 4).
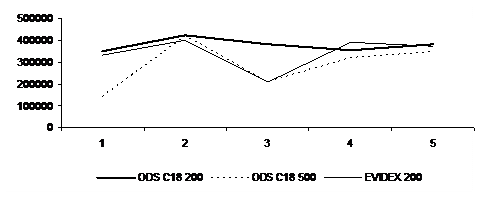
Рис.4. Сравнение результатов исследования контрольных образцов мочи с концентрацией феназепама 1 мг/л с использованием различных патронов для ТФЭ (ODS C18 200, ODS C18 500, EVIDEX 200) (среднее значение пяти измерений).
Как видно из представленной диаграммы, стабильные результаты наблюдаются при использовании патронов ODS C18 200, которые были выбраны нами для дальнейшего исследования.
При проведении сравнительного анализа элюирующей способности органических растворителей (метанол, этилацетат, бутилацетат) лучшие результаты (качество пиков, их четкость, высокая воспроизводимость, чувствительность) получены при использовании бутилацетата. Оптимальный объем растворителя для патронов ODS C18 200 – 0,5 мл. Процедура проведения жидкость-жидкостной экстракции [5]: к 1 мл тестового контрольного образца мочи добавляли 300 мкл трис-буфера, 50 мкл р-ра внутреннего стандарта (ДФА), экстрагировали 300 мкл бутилацетата (интенсивно встряхивая на вибрационном шейкере в течение 2 минут); центрифугировали в течение 5 минут (4000 об/мин), 250 мкл органической фазы переносили в виалу и испаряли под током инертного газа.
По результатам интенсивностей пиков, полученных методом ХМС, после пробоподготовки мочи, содержащей 0.1, 0.2, 0.3, 0.5 и 1 мг/л феназепама методами ЖЖЭ и ТФЭ составлена диаграмма (рис. 5).
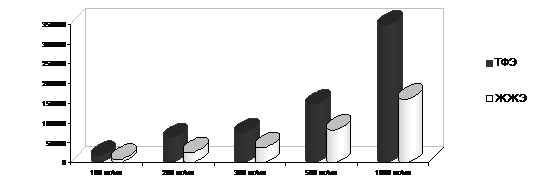
Рис.5. Сравнение результатов исследования контрольных образцов мочи с различными концентрациями феназепама с использованием ТФЭ и ЖЖЭ. (среднее значение пяти измерений).
Сравнительный анализ двух методик пробоподготовки ТФЭ и ЖЖЭ показал существенные преимущества ТФЭ перед ЖЖЭ.
На рис.6,7 представлены хроматограмма извлечения из мочи и масс-спектр силилированного производного феназепама.
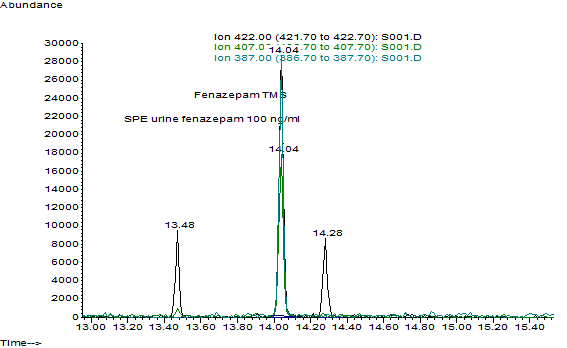
Рис.6. Хроматограмма экстракта (ТФЭ на ODS C18 200) из 1 мл мочи с концентрацией феназепама 0.1 мг/л (100 нг/мл) с экстракцией по характеристическим ионам.
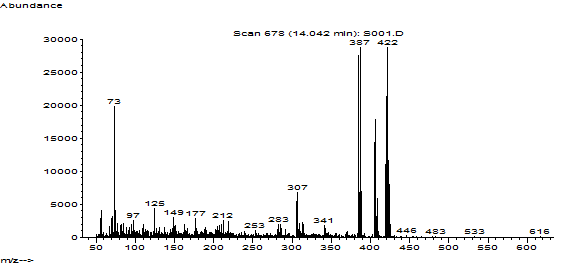
Рис.7. Масс-спектр силилированного производного феназепама.
Процедура проведения ТФЭ тестовых контрольных образцов сыворотки на патронах EVIDEX 200 и ODS C18 200 представлена в таблице 3.
Таблица 3
Процедура ТФЭ на патронах EVIDEX 200 и ODS C18 200
Концентрация феназепама в плазме (мг/л) |
0.1 | 0.5 |
1 |
Этапы ТФЭ: 1.Кондиционирование |
Раствор метанола в воде (1:1) – 1 мл | ||
2.Загрузка образца | 0,5 мл плазмы, 50 мкл раствора феназепама соответствующей концентрации, 50 мкл раствора MPPH* 10 мг/л (внутренний стандарт) | ||
3.Промывка | 5% раствор метанола – 1 мл | ||
4.Элюирование | Бутилацетат - 0,5 мл | ||
*MPPH – ((5-метилфенил)-5-фенилгидантон)
В процессе проведения экстракции, на стадиях промывки, а впоследствии элюирования, отмечено:
- Для прохождения образца со скоростью 1 мл/мин через патрон EVIDEX 200 потребовалось создать давление в три раза большее, чем для патронов ODS C 18 200 (~3х103 Па).
- В элюате, полученном при использовании патронов EVIDEX 200, также наблюдался небольшой осадок, что в дальнейшем мешало проведению газохроматографического исследования.
С учётом основных характеристик патронов ODS C18 200 и EVIDEX 200, а также результатов эксперимента, сорбент патронов ODS C18 200 задерживает белок более эффективно при всем этом, не снижая степень извлечения феназепама.
Количественное определение проводили методом высоко эффективной жидкостной хроматографии с диодно-матричным детектором (ВЭЖХ с ДМД) с использованием патронов ODS C18 200.
2. Метод высоко эффективной жидкостной хроматографии (ВЭЖХ)
Исследование проводилось на жидкостном хроматографе Agilent 1100 с диодно-матричным детектором (DAD) в градиентном режиме. Колонка ZORBAX Eclipse XDB-C8 4,6x150 мм, размер частиц 5 мкм. Предколонка Zorbax SB-C18 4,6 х 12,5 мм, 5 мкм; температура термостата колонки – 30˚C.
- Элюент A: Вода деионизированная;
- Элюент B: Ацетонитрил HPLC Gradient
- Элюент D: Фосфатный буфер pH 3,8.
- Градиент:
Время (минуты) |
%B | %D |
0 | 15 |
85 |
8 |
35 | 65 |
17 | 65 |
35 |
21 |
65 | 20 |
26 | 15 |
20 |
0-7 |
15 | 85 |
- Скорость потока: 1 мл/мин; от 0-7 минут кондиционирование.
- Длина волны: 220 нм.
- Объем вводимой пробы 40 мкл.
Идентификация наблюдаемых на хроматограмме пиков осуществлялась по временам удерживания и УФ спектрам веществ.
По вышеописанной методике строили калибровочные графики. Калибровочные образцы содержали следующие концентрации феназепама в крови: 0.1, 0.5, 1.0 мг/л.
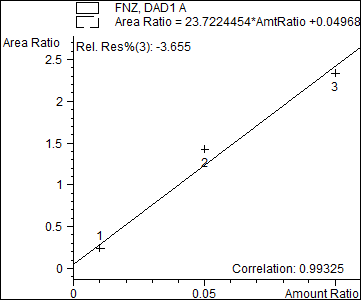
Рис.8. Калибровочный график.
Количественное определение проводилось с использованием метода внутреннего стандарта, внутренний стандарт- MPPH.
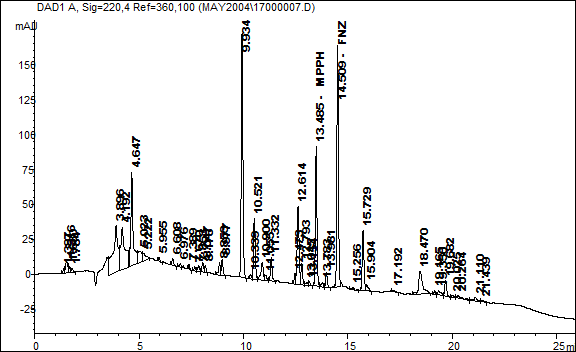
Рис.9. Хроматограмма экстракта (ТФЭ на ODS C18 200) из крови реального образца, поступившего на анализ в СХО ГУ Бюро СМЭ МЗ МО.
Проведенная нами статистическая обработка результатов исследования показала, что полученные данные укладываются в норму допустимых отклонений [1].
Были проведены исследования на наличие производных бензодиазепина с использованием пробоподготовки методом ТФЭ и ЖЖЭ биообъектов, поступивших на исследования в СХО ГУ Бюро судебно-медицинской экспертизы МЗ МО. Результаты трех из них представлены ниже.
№0001 женщина 1988 г.р.
- Причина поступления – отравление феназепамом.
- Наименование проб (объектов): моча
- Отравление наступило – 23.03.04 в 18 часов;
- Пробы отобраны – 24.03.04 в 11.30 часов.
- Цель исследования: наркотические вещества, производные бензодиазепина.
- Результаты анализа ПФИА мочи: нг/мл
- Опиаты - отрицательный;
- Производные бензодиазепина - 67,40 / отрицательный;
- Амфетамины - отрицательный;
- Каннабиноиды - отрицательный.
- Результаты ГХ-МС исследования мочи с использованием ЖЖЭ на наличие производных бензодиазепина: отрицательный.
- Результаты ГХ-МС исследования мочи с использованием ТФЭ на наличие производных бензодиазепина: обнаружен феназепам.
№0002 женщина, 1980 г.р., инвалид 4 группы
- Обстоятельства дела: 24.03 в 17 часов с суицидальной целью приняла таблетки феназепама.
- Диагноз: суицидальная попытка отравления феназепамом.
- Цель исследования: производные бензодиазепина.
- Наименование проб (объектов): моча и кровь
- Результаты ПФИА мочи: нг/мл
- Производные бензодиазепина отрицательный
- Результаты ГХ-МС исследования крови с использованием ЖЖЭ: обнаружен феназепам.
- Результаты ГХ-МС исследования крови с использованием ТФЭ: обнаружен феназепам.
- Результаты ГХ-МС исследования мочи с использованием ЖЖЭ: обнаружен феназепам.
- Результаты ГХ-МС мочи с использованием ТФЭ: обнаружен феназепам.
- Результаты количественного определения феназепама в сывортке (0,5 мл) методом ВЭЖХ с ДМД с использованием ТФЭ: концентрация феназепама составила 1,79 мг/л.
№0003 труп мужчины, 1976 г.р.,
- Обстоятельства дела: подозрение на передозировку наркотическими и лекарственными препаратами.
- Диагноз: передозировка наркотическими и лекарственными препаратами.
- Цель исследования: наркотические вещества, производные бензодиазепина.
- Наименование проб (объектов): моча и кровь
- Результаты ПФИА: нг/мл
- Опиаты положительный
- Производные бензодиазепина 528,40/положительный
- Результаты ГХ-МС исследования мочи с использованием ЖЖЭ: обнаружен 6-моноацетилморфин (6МАМ), морфин, кодеин, нордазепам, хингамин.
- Результаты ГХ-МС исследования мочи с использованием ТФЭ: обнаружен нордазепам.
- Результаты ГХ-МС исследования крови с использованием ЖЖЭ: обнаружен 6МАМ, морфин, диазепам, нордазепам, хингамин.
- Результаты ГХ-МС исследования крови с использованием ТФЭ: обнаружен диазепам, нордазепам, феназепам.
- Результаты количественного определения феназепама в сывортке (0,5 мл) методом ВЭЖХ с ДМД с использованием ТФЭ: концентрация феназепама составила 0,24 мг/л.
Выводы
Внедрение в рутинный химико-токсикологический и судебно-химический анализы метода ТФЭ биожидкостей для определения и обнаружения производных бензодиазепина, в том числе феназепама позволило:
- · сократить время проведения серийных анализов
- · улучшить качество извлечений
- · повысить чувствительность и расширить спектр определяемых веществ, присутствующих в биообъекте в маленьких концентрациях, т.е. избежать ложно-отрицательных результатов.
Метод пробоподготовки с использованием ТФЭ специфичен и хорошо воспроизводим.
Предложенная методика проведения ТФЭ применена в судебно-химическом отделе ГУ Бюро судебно-медицинской экспертизы Министерства здравоохранения Московской области в качестве пробоподготовки биожидкостей для обнаружения производных бензодиазепина в моче методом газовой хроматографии с масс-селективным детектором и для количественного определения производных бензодиазепина в крови методом высоко эффективной жидкостной хроматографии.
похожие статьи
Перспективы использования параметров окислительной модификафии белков сыворотки крови для установления длительности агонального периода / Эделев И.С., Обухова Л.М., Андриянова Н.А., Эделев Н.С. // Судебная медицина. — 2019. — №3. — С. 28-32.
Обнаружение рокурония в биологических объектах методом высокоэффективной жидкостной хроматографии/масс-спектрометрии / Матвеева А.А., Федорова К.В., Лопушанская Е.М., Киреева А.В. // Судебная медицина. — 2019. — №2. — С. 49-51.
Изучение распределения неостигмина метилсульфата в организме теплокровных животных после внутрижелудочного введения / Алехина М.И., Шорманов В.К., Никитина Т.Н., Маркелова А.М. // Судебно-медицинская экспертиза. — М., 2019. — №2. — С. 40-47.
Обнаружение 25B-NBOMe — производного фенилэтиламина в биологическом материале / Барсегян С.С., Кирюшин А.Н., Ерощенко Н.Н., Туаева Н.О., Носырев А.Е., Кирилюк А.А. // Судебно-медицинская экспертиза. — М., 2019. — №2. — С. 34-39.
Особенности распределения 2,4- и 2,6-ди-трет-бутилгидроксибензола в организме теплокровных животных / Шорманов В.К., Цацуа Е.П., Асташкина А.П. // Судебно-медицинская экспертиза. — М., 2019. — №1. — С. 36-42.