О выделении трихлорметафоса из биологического материала дистилляцией с водяным паром
/ Стадниченко Э.И., Волкова Е.А. // Судебно-медицинская экспертиза. — М., 1976 — №1. — С. 27-31.

УДК 340.67:615.285.7
Кафедра токсикологической химии (зав.— доц.Е. А. Волкова) Харьковского фармацевтического института
О выделении трихлорметафоса из биологического материала дистилляцией с водяным паром. Стадниченко Э.И., Волкова Е.А. Суд.-мед. эксперт., 1976, № 1, с. 27
Выявлены оптимальные условия дистилляции из водных виннокислых смесей. Разработан метод изолирования и очистки ФОС из печени, почек и желудка с содержимым. Получены положительные результаты на животных.
Таблиц 2.
ISOLATING TRICHLORMETAPHOS FROM BIOLOGICAL MATTER BY VAPOUR DISTILLATION
Stadnichenko E. I., Volkova E. A.
The optimal conditions for the distillation from tartaric acidated mixtures are demonstrated. A technique of isolation and purification of organophosphoric compounds from liver, kidney, and stomach with gastric contents is recommended. The technique was successfully tested on animals.
При неправильном хранении и использовании трихлорметафос (ФОС) может быть причиной отравления людей. Ранее мы разработали экстракционно-хроматографический метод выделения и очистки трихлорметафоса при химико-токсикологических исследованиях (Э.И. Стадниченко и Е.А. Волкова, 1973). Учитывая, что трихлорметафос обладает определенной летучестью, представляло интерес изучить возможность использования метода дистилляции с водяным паром для выделения и очистки ФОС из объектов исследования.
Известно, что некоторые малолетучие соединения более легко перегоняются с водяным паром при введении в перегоняемую смесь высаливающих веществ (Э.Л. Мортон, 1941). При выявлении оптимальных условий изолирования трихлорметафоса указанным методом исследовали: влияние добавок высаливателя, количество анализируемого вещества в перегоняемой смеси и объема дистиллята на полноту выделения ФОС. Указанную зависимость изучали на водных смесях трихлорметафоса в присутствии высаливателя — хлорида натрия или без него.
Для исследования использовали трихлорметафос с температурой размягчения 33— 34“. Технический препарат обрабатывали водой, извлекали из водной эмульсии хлороформом, растворитель удаляли, выделившееся масло подвергали фракционной разгонке при нагревании под уменьшенным давлением (1 мм рт. ст.) до образования белого кристаллического налета на стенках холодильника. Затем налет смывали эфиром, эфир испаряли на воздухе, жидкую густую массу высушивали над хлоридом кальция в эксикаторе.
Методика исследования водных смесей
В колбу для дистилляции емкостью 250 мл помещали трихлорметафос (0,3— 30 мг), дистиллированную воду (100 мл), 1,5 г винной кислоты и различные количества хлорида натрия (20—60 г) или без него. Смесь подвергали дистилляции с водяным паром со скоростью около 80 капель в минуту. Собирали дистиллят (100, 200 мл), производили экстракцию ФОС хлороформом (3 раза по 30—35 или 60—70 мл соответственно), хлороформные вытяжки объединяли, высушивали безводным сульфатом натрия, фильтровали и удаляли растворитель при нагревании на водяной бане при температуре около 60° до объема I—2 мл, а остаток — при комнатной температуре. В сухом остатке определяли трихлорметафос по фосфору (Э.И. Стадниченко, Е.А. Волкова, 1974).
Установлено, что методом дистилляции с водяным паром без высаливателя можно выделить 3,2—12,5% трихлорметафоса. Введение в перегоняемую смесь 20 г хлорида натрия увеличивает выход ФОС в 100 мл дистиллята до 17—25%, прибавление 40 г высаливателя — до 34—44%. Дальнейшее увеличение количества соли не повышает выход трихлорметафоса в дистиллят.
В изученных пределах концентраций (0,3—30 мг) полнота выделения анализируемого вещества практически не зависит от количества его в перегоняемой смеси и объема (100—200 мл) собираемого дистиллята: в первые 100 мл переходит 35,5±3,4%, в 200 мл — 35,4±9,4 % трихлорметафоса.
Выявленные оптимальные условия дистилляции трихлорметафоса из водных смесей использовали для изолирования его из объектов биологического происхождения.
Методика исследования биологического материала
Измельчали 100 г биологического материала (печень, почки, желудок с содержимым), брали навеску 20 г и прибавляли к ней определенное количество трихлорметафоса в гексане. Смесь контактировали 30 мин при комнатной температуре при помешивании, затем в колбу с биологическим материалом прибавляли 80 мл воды, 1,5 г винной кислоты, 40 г хлорида натрия и подвергали дистилляции с водяным паром со скоростью около 80 капель в минуту. Собирали 100 мл дистиллята и поступали, как описано выше (до получения сухого остатка). Сухой остаток растворяли в 2—3 мл ацетона и количественно переносили в колбу объемом 5 мл, раствор доводили до метки ацетоном. Полученный экстракт подвергали анализу в тот же день (при хранении исследуемого раствора более 2 дней определение трихлорметафоса затрудняется).
Качественный анализ
1. Энзиматическое исследование
Анализ производили по методике, предложенной А.А. Покровским и Л.Г. Пономаревой (1964, 1965). В одну микропробирку помещали 2 капли исследуемого экстракта, в другую — 2 капли ацетона, затем в обе — по 18 капель дистиллированной воды, по 2 капли 2% водного раствора холинэстеразы и оставляли для контактирования на 15 мин. После этого в каждую из пробирок прибавляли по 2 капли индикаторно-буферного реактива (приготовление см: «Сборник официальных материалов по контролю за ядохимикатами, применяемыми в сельском хозяйстве», М., «Медицина», 1966, с. 202). Запаздывание изменения цвета исследуемого раствора от синего к зеленому по сравнению с контрольным опытом или от зеленого к желто-зеленому (при содержании 1—2 мкг трихлорметафоса) принимали за положительный результат реакции. Чувствительность испытания — 1 мкг ФОС в 2 каплях анализируемого раствора.
При положительном результате реакции можно предположить наличие трихлор-метафоса или других ФОС в объекте исследования. Независимо от результата испытания анализ следует продолжить другими реакциями (трихлорметафос и его метаболиты).
2. Хроматографическое исследование
А. По 2, 4, 5-трихлорфенолу.
Концентрировали 0,5—0,6 мл экстракта до 0,1—0,2 мл. На полосу хроматографической бумаги шириной 5 см, с продольным разрезом посредине в одну точку наносили экстракт, в другую — раствор метчика (10—20 мкг трихлорметафоса в 0,1 мл ацетона), каждую последующую каплю после полного высыхания предыдущей. Диаметр пятен для экстрактов 1,2 см, раствора метчика — 0,5 см. Бумагу с пробами помещали в хроматографическую камеру (цилиндр с притертой пробкой), на дно которой за Р/г—2 ч до анализа наливали подвижный растворитель: спирт — ацетон — вода (1:1:12). Бумагу выдерживали в атмосфере камеры в течение 30 мин, а затем опускали в растворитель на 1—1,2 см и в таком виде оставляли на 2—3 ч.
После этого хроматограмму вынимали, высушивали на воздухе в течение 30 мин и проявляли, опрыскивая растворами 4-аминоантипири-на и гексацианоферриата калия после предварительной обработки раствором едкого натра (Э.И. Стадниченко, Е.А. Волкова, 1973). Чувствительность реакции — до 4 мкг в анализируемом пятне. Реакция специфична в присутствии исследованных нами ФОС (хлорофос, карбофос, фосфамид, армии, фосфакол, тиофос, метафос), а также ряда фосфорорганических и других соединений, не дающих при гидролизе фенолов и нафтолов с открытым или способным открываться п-положением по отношению к фенольному гидроксилу (Н.П. Яворский, 1974).
Таблица 1
| Добавлено трихлорметафоса (в мкг) | Определено трихлорметафоса (в %) | Метрологические данные |
|---|---|---|
23 | 105 | x = 98,0 |
27 | 90 | σ = 5,7 |
36 | 95 | σx = 2,5 |
43 | 100 | I0,95 = 7,0 |
| 43 | 100 | а = 98 ± 7% |
Определение трихлорметафоса в биологических экстрактах
Отрицательный результат двух указанных реакций или одной последней позволяет сделать вывод о ненахождении трихлорметафоса и продуктов его метаболизма в биологическом материале.
Б. По тиофосфатной связи.
При положительном результате реакции с 4-аминоантипирином пробу экстракта объемом 1,8—2 мл подвергали хроматографическому анализу, как описано выше. Бумагу предварительно промывали подвижным растворителем, давая ему подняться вверх почти до конца, а затем высушивали ее на воздухе, проба-метчик содержала 40 мкг трихлорметафоса.
Хроматограммы опрыскивали смесью равных объемов 2% водного раствора нитрата серебра и 0,4% раствора бромфенолового синего в ацетоне (В.П. Маккинли, 1967), нагревали 10—15 мин при 50" и затем погружали в кювету, содержащую 0,1 % водный раствор лимонной кислоты. Наблюдали голубые или синие пятна на желтом фоне. Чувствительность реакции — до 20 мкг трихлорметафоса в анализируемом пятне.
Положительный результат реакции на тиофосфатную связь в сочетании с двумя указанными выше позволяет сделать вывод о нахождении трихлорметафоса или его ближайших гомологов (трихлорметафос-3 и др.) в биологическом материале.
Количественный анализ
Предварительно установили, что в пределах 6—80 мкг трихлорметафоса в пятне на хроматограммах наблюдается прямая зависимость площади окрашенного пятна (реакция с 4-аминоантипирином) от количества ФОС.
На хроматографическую бумагу в одну точку наносили от 0,1 до 0,6 мл исследуемого экстракта в зависимости от результата качественного испытания (диаметр пятен при анализе 0,1—0,2 мл — 0,7—0,8 см, при 0,3—0,4 мл — I см, при 0,4 — 0,6 мл — 1,2 см).
В другую точку наносили такое же количество экстракта, но с добавлением к нему стандартного раствора трихлорметафоса, содержащего 10—20 мкг ФОС. Техника нанесения экстрактов, условия хроматографирования и проявления хроматограмм описаны при качественном исследовании ФОС по 2, 4, 5-трихлорфенолу.
Площадь окрашенных пятен рассчитывали по формуле для измерения площади круга (2nR2) или, как рекомендует Е.С. Косматый (1966), прямым подсчетом квадратов на миллиметровой, пропитанной жиром бумаге, наложенной на пятно. Количество трихлорметафоса в анализируемом объеме экстракта определяли по формуле:
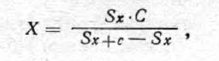
где X — количество исследуемого вещества (в мкг) в пятне; С — количество трихлорметафоса (в мкг), добавленного к экстракту, наносимому на бумагу; Sx — площадь пятна (в мм2) исследуемого вещества; Sx+c — площадь пятна (в мм2) исследуемого вещества с добавкой.
Результаты определения трихлорметафоса по площади пятна на хроматограммах в присутствии биологического экстракта (печень) представлены в табл. 1.
Как видно из табл. 1, при анализе 23—43 мкг трихлорметафоса, добавленного к экстракту биологического материала, воспроизводимость метода ±5,7%, точность ±7%.
Для количественного определения трихлорметафоса наряду с описанным выше методом применяли разработанный нами ранее метод анализа ФОС по синему фосфорномолибденовому гетерополикомплексу (Э.И. Стадниченко, Е.А. Волкова, 1974). Для исследования брали 0,2 мл экстракта (предварительная хроматографическая очистка не требовалась). Метод использовали и для качественного испытания исследуемого вещества.
Таблица 2
Определение трихлорметафоса, выделенного из органов трупа человека дистилляцией с водяным паром
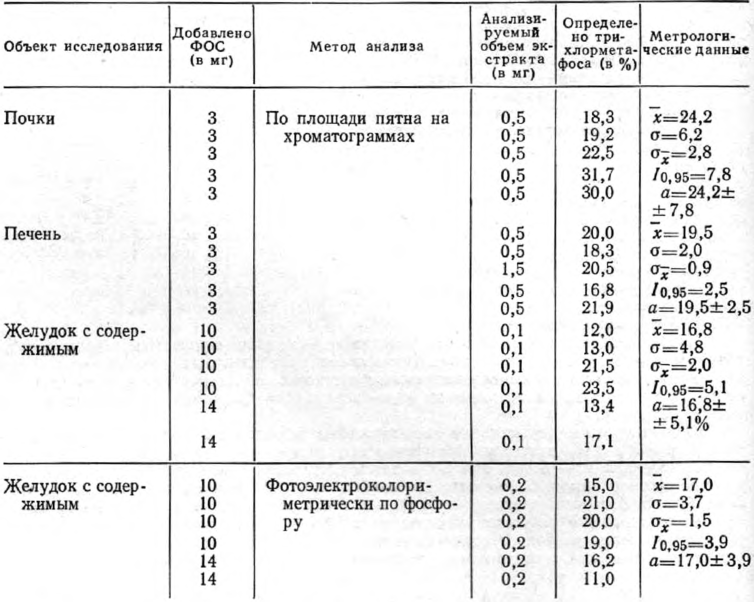
Результаты количественного определения трихлорметафоса после выделения его из органов трупа человека методом дистилляции с водяным паром представлены в табл. 2.
Как видно из табл. 2, метод позволяет выделить 24,2±7,8% трихлорметафоса из почек, 19,5±2,5% — из печени, 16,8±5,1% — из желудка с содержимым (определение по площади пятна) или 17,0±3,9% (фотоэлектроколориметрическое определение по фосфору). Чувствительность метода количественного определения трихлорметафоса по площади пятна на хроматограммах — 0,7 мг в 20 г объекта.
С помощью метода дистилляции с водяным паром можно выделить и определить качественно (энзиматической пробой, реакциями по 2, 4, 5-трихлорфенолу, тиофосфатной связи, фосфору) и количественно (по синему фосфорномолибденовому гетерополикомплексу) до 3 мг трихлорметафоса в 20 г объекта (навеска органа может быть увеличена до 50 г).
Разработанный метод анализа трихлорметафоса в органах трупа человека применили для исследования биологического материала (20—50 г печени), к которому добавляли трихлорметафос (10 мг) и оставляли на хранение (1—5 нед) при различной температуре (18—22 и 0°).
Установили, что в течение 2 нед хранения биологического материала при комнатной температуре или 3 нед — в холодильнике можно обнаружить трихлорметафос всеми названными выше реакциями. Через 2 нед хранения объекта при комнатной температуре определяли 9,8±3,2% трихлорметафоса, при хранении в холодильнике — 14,8 ±5,1 %.
После 2 и 3 нед хранения биологического материала при соответствующем температурном режиме (18—22 и 0°) трихлорметафос определяли качественно только одной реакцией по 2, 4, 5-трихлорфенолу. Дальнейшему анализу ФОС мешали продукты гнилостного разложения (слепой опыт давал положительную реакцию с 4-аминоантипирином).
Разработанный метод выделения трихлорметафоса из биологического материала дистилляцией с водяным паром испытали на животных. Белым крысам через рот вводили раствор трихлорметафоса в кукурузном масле из расчета 50—150 мг/кг, часть крыс служили контролем. После гибели крыс вскрывали и подвергали анализу печень, почки, желудок с содержимым. Исследование на трихлорметафос производили по 2, 4, 5-трихлорфенолу и фосфору. Резко положительный результат реакции наблюдали при анализе желудка, положительный — печени, слабоположительный — почек.
Вывод
Выявлены оптимальные условия дистилляции трихлорметафоса с водяным паром из водных виннокислых смесей, на этой основе разработан метод его изолирования из биологического материала (печень, почки, желудок с содержимым). Методика испытана на животных (белых крысах) и получены положительные результаты.
похожие статьи
Судебно-медицинская экспертиза интоксикаций бытовым и серосодержащим природным газом : пособие для врачей / Калинина Е.Ю., Ягмуров О.Д., Сетко Н.П. — 2016.
Анализ причин насильственной смерти в результате отравления за 2015–2019 гг. (по данным норильского отделения Красноярского краевого бюро судебно-медицинской экспертизы) / Кошак К.В., Коплатадзе И.Г., Толмачева С.К., Слащинин Г.А., Алябьев Ф.В., Фомина И.Е., Аверченко И.В., Хлуднева Н.В., Бокиев М.У., Закурдаева А.Д. // Избранные вопросы судебно-медицинской экспертизы. — Хабаровск, 2020. — №19. — С. 73-75.
Редкая ошибка / Вонгродзский В.А. // Судебно-медицинская экспертиза. — М.: Изд-во Наркомздрава, 1928. — №8. — С. 116-119.
Уголь, как противоядие при разных отравлениях / Лейбензон Е.А. // Судебно-медицинская экспертиза. — М.: Изд-во Наркомздрава, 1928. — №8. — С. 45-60.
К вопросу о химическом распознавании сероуглерода в крови при отравлениях / Кромер Н. // Судебно-медицинская экспертиза. — М.: Изд-во Наркомздрава, 1928. — №8. — С. 42-44.