Определение гликозидов дигиталиса в трупном материале фотометрическим методом на основе реакции взаимодействия с 2,2', 4,4'-тетранитродифенилом
/ Власенко Л.М. // Судебно-медицинская экспертиза. — М., 1976 — №4. — С. 23-27.

Научно-исследовательский институт судебной медицины (дир. — проф. В.И. Прозоровский) Министерства здравоохранения СССР, Москва
УДК 340.67: [547.918:582.951.64
Определение гликозидов дигиталиса в трупном материале фотометрическим методом на основе реакции взаимодействия с 2,2', 4,4'-тетранитродифенилом. Суд.-мед. эксперт., 1976, № 4, с. 23-27.
Разработан новый метод фотоколориметрического определения гликозидов дигиталиса во внутренних органах (печень, почки, желудок и кишечник с содержимым). Метод основан на реакции взаимодействия гликозидов с 2,2', 4,4/-тетранитродифенилом и позволяет повысить чувствительность судебно-химического определения в 3—5 раз.
Таблиц 5. Иллюстрация 1.
В научно-исследовательском институте судебной медицины разработан судебно-химический метод качественного и количественного определения отравлений наиболее часто встречающимися в экспертной практике сердечными гликозидами. Метод характеризуется высокой чувствительностью обнаружения (20—50 мкг в 100 г печени), однако граница определения, которое осуществлялось фотоколориметрическим методом на основе реакции с 2,4-динитродифенилсульфоном, находится в пределах 300—500 мкг в 100 г органа. Вследствие такого значительного разрыва в границах определение выделенных количеств гликозидов в экспертном материале не всегда возможно.
Целью настоящей работы явилось изучение (на примере дигитоксина и ланатозида С) возможности дальнейшего повышения чувствительности количественного определения гликозидов дигиталиса в трупном материале. Использован предложенный Rabitzsch и Tambor (1969) для исследования растворов дигитоксина, дигоксина, гитоксина и четырех их производных фотоколориметрический метод, основанный на реакции взаимодействия гликозидов с 2,2', 4,4/-тетранитродифенилом в щелочной среде. По данным авторов, этот метод обладает более высокой чувствительностью, чем метод, основанный на реакции с 2,4-динитродифенилсульфоном.
В соответствии с методикой, детально разработанной немецкими исследователями для определения дигитоксина, были отработаны унифицированные для определения дигитоксина, дигоксина и ланатозида С условия.
Методика. К спиртовому раствору, содержащему определенное количество гликозида, добавляли спирт до объема 2 мл и 2,5 мл 0,15% спиртового раствора 2,2 , 4,4'-тетранитродифенила (свежеприготовленного или хранившегося в темноте при 0—30° в течение не более 7 сут). Пробирку охлаждали водой со льдом до температуры 18—20°, прибавляли 0,5 мл свежеприготовленного 0,15 и. водного раствора едкого натра, сильно встряхивали и охлаждали льдом. Через определенное время оптическую плотность раствора, окрашенного в голубой цвет, измеряли на фотоэлектроколориметре ФЭК—56М (светофильтр № 8, кювета 5 мм, фон — контроль реактивов).
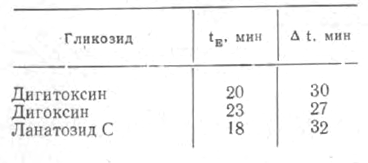
Установленные по данной методике для трех гликозидов экспозиция (tE) и время, в течение которого максимум окрашивания не изменялся (At), приводятся в табл. 1.
Таблица 1
Реакция гликозидов дигиталиса с 2,2', 4, 4 '-тетранитродифенилом
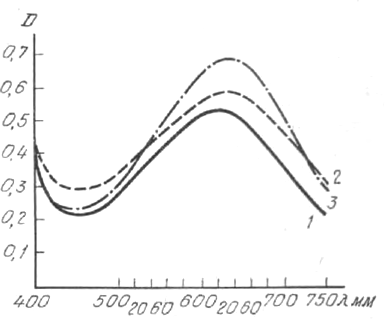
Спектры поглощения продуктов взаимодействия гликозидов с 2 ,2 ', 4 ,4 '-тетранитроди- фенилом.
1 — дигитоксин (10 мкг/мл); 2 — ланатозид С (20 мкг/мл); 3 — дигоксин (10 мкг/мл).
Полученные данные свидетельствуют о достаточной стабильности окраски раствора, а следовательно, и продуктов взаимодействия гликозидов с тетранитродифенилом, что является преимуществом данной реакции (по сравнению с реакцией с 2,4-динитродифенил-сульфоном) и говорит в пользу ее использования в фотоколориметрическом методе. Общими для всех трех гликозидов являются экспозиция (tE) 23 мин, стабильность окрашивания (At) 27 мин.
Значительное преимущество заключается еще и в том, что в отличие от реакции взаимодействия гликозидов с 2,4-динитродифенил-сульфоном, при которой образуется желтый фон, в реакции с тетранитродифенилом контроль реактивов практически бесцветный. Благодаря этому в присутствии даже 3—4 мкг исследуемых гликозидов в колориметрируемом объеме (5 мл) можно различить слабое голубое окрашивание раствора.
Выявляемые концентрации гликозидов 2—20 мкг/мл подчиняются закону Ламберта — Бера.
Для установления максимума поглощения ланатозида С в реакции с 2,2/,4,4'-тетранитродифенилом нами изучен спектр его поглощения. Одновременно проверены в условиях нашего опыта спектры дигитоксина и дигоксина, которые уже описаны в литературе. Снятие спектров производилось на регистрирующем спектрофотометре СФ-14 в диапазоне длин волн 400—750 нм. Время развертки спектра 2 мин, скорость развертки — 4. Полученные и представленные на рисунке спектры сходны. Оптимальной общей для всех трех гликозидов является область поглощения 620—640 нм.
Унифицированные условия метода применили к исследованию трупного материала на дигитоксин и ланатозид С.
Методика. К 100 г измельченной печени или ткани другого органа (средняя проба) трупа человека, погибшего от травмы, прибавляли определенное количество дигитоксина или ланатозида С и оставляли до следующего дня при комнатной температуре. Изолирование гликозидов из органов и последующую экстракцию производили с помощью ранее разработанных методов (Л. М, Власенко, 1972, 1973).
Сухой остаток, полученный при испарении эфирного (дигитоксин) или спиртохлороформного (ланатозид С) извлечения, тщательно обрабатывали 5 мл этанола, центрифугировали. В аликвотной части (0,5—0,75 мл) центрифугата проводили фотометрическое определение гликозидов по описанной выше методике.
Результаты определения дигитоксина и ланатозида С, извлеченных из ткани печени, представлены в табл. 2 и 3.
Таблица 2
Определение дигитоксина в ткани печени

Таблица 3
Определение ланатозида С в ткани печени
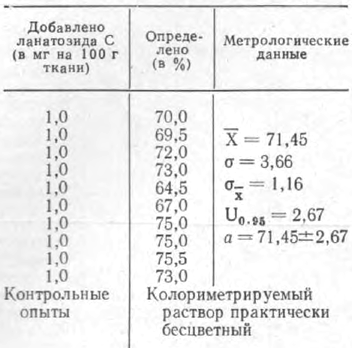
Полученные результаты свидетельствуют о достаточной для экспертных целей воспроизводимости и точности метода. В табл. 4 приведены данные о границах определения ланатозида С и дигитоксина в трупном материале по описанной методике.
Таблица 4
Границы фотоколориметрического определения дигитоксина и ланатозида С в ткани печени на основе реакции с 2,2', 4 4'-тетранитродифенилом
| Добавлено гликозида (в мг на 100 г ткани) | Объем раствора (в мл) | Окраска колориметрируемого раствора при анализе на | ||
|---|---|---|---|---|
| общий | исследуемый | дигитоксин | ланатозид С | |
| 0,3 | 5,0 | 0,5 | Голубая | Голубая или зеленовато-голубая |
| 0,2 | 5.0 | 0,5 | » | Голубовато-серая или зеленая |
| 0,1 | 5.0 | 0,5 | Сомнительная | Сомнительная |
| 0,75 | Голубовато-серая | Голубовато-cepая | ||
| 0 | 5.0 | 0,5 | Практически бесцветная | Слегка желтоватая |
| 0,75 | То же | То же | ||
Примечание. Приведены средние результаты 3 — 5 опытов.
Как видно из табл. 4, наименьшая концентрация гликозидов, при которой еще образуется заметное характерное окрашивание и которая, следовательно, может быть определена, составляет 100 мкг на 100 г печени (при условии анализа 0,75 из 5 мл исследуемого раствора). Это свидетельствует о более высокой чувствительности предложенного нами метода определения сердечных гликозидов, превысившей в 3— 5 раз чувствительность метода, основанного на реакции с 2,4-динитро-дифенилсульфоном. Более чистая голубая окраска получается при исследовании на дигитоксин, так как эфир извлекает значительно меньше экстрактивных веществ из ткани органа, чем смесь хлороформа с этанолом (исследование на ланатозид С).
Таблица 5
Влияние экстрактивных веществ из ткани почек разных трупов на определение ланатозида С
| Группа опытов | Ткань почки из трупов (№ п/п) | Добавлено ланатозида С (в мг на 100 г ткани) | Окраска колоримет- рируемого раствора | Плотность раствора | % | Среднее значение (в %) | Воспроиз- водимость (в %) |
|---|---|---|---|---|---|---|---|
| 1-я | 1 | 0,2 | Светло-голубая | 0,037 | 70,0 | ||
| 1 | 0 | Практически бесцветная | 0 | ||||
| 2 | 0,2 | Светло-голубая | 0,038 | 72,5 | |||
| 2 | 0 | Желтоватая | 0,007 | ||||
| 3 | 0,2 | Светло-голубая | 0,039 | 72,5 | 72,50 | 1,78 | |
| 3 | 0 | Практически бесцветная | 0 | 0 | |||
| 4 | 0,2 | Светло-голубая | 0,041 | 75,0 | |||
| 4 | 0 | Желтоватая | 0,006 | ||||
| 2-я | 5 | 0,2 | Серо-голубая | 0,040 | 75,0 | ||
| 5 | 0 | Розовато-желтая | 0,021 | ||||
| 6 | 0,2 | Светло-голубая | 0,040 | 75,0 | |||
| 6 | 0 | Слегка розоватая | 0,009 | ||||
| 7 | 0,2 | Голубовато-серая | 0,040 | 75,0 | 76,25 | 2,16 | |
| 7 | 0 | Розовато-желтая | 0,025 | ||||
| 8 | 0,2 | Голубая | 0,043 | 80,0 | |||
| 8 | 0 | Розовато-желтая | 0,009 |
Примечание. Во всех случаях исследовали 1/10 часть извлечения из 100 г ткани почки.
Результаты исследования контрольных проб (см. табл. 2—4) указывают на отсутствие влияния экстрактивных веществ из печени на определение гликозидов; колориметрируемые растворы были либо слегка желтоватыми, либо практически бесцветными.
Для изучения влияния экстрактивных веществ из ткани почек, желудка и кишечника с содержимым ставили «холостые» опыты с контрольными пробами перечисленных органов от трупов лиц (4), погибших в результате травмы. Установлено, что экстрактивные вещества из желудка и кишечника с содержимым также не препятствуют определению гликозидов в реакции с 2,2',4,4'-тетранитродифенилом. При исследовании этих органов как на дигитоксин (эфирное извлечение), так и на ланатозид С (спирто-хлороформное извлечение) колориметрируемые растворы практически были бесцветными. Определению не мешают и эфирные экстракты (исследование на дигитоксин) из ткани почек, но спирто-хлороформные их экстракты (исследование на ланатозид С) нередко дают розоватое окрашивание. Дополнительно проведенные нами опыты с тканями почек от 8 трупов разделены (табл. 5) на 2 группы. В 1-ю группу отнесено исследование почек с желтоватым (или бесцветным), во 2-ю — с розоватым оттенком колориметрируемых растворов.
Как видно, образующийся розовый оттенок не маскирует характерное окрашивание даже при пограничных концентрациях гликозидов (2-я группа) и существенно не препятствует его количественному определению. Воспроизводимость результатов в опытах обеих групп практически одинакова. Сравнение средних результатов опытов 1-й и 2-й групп показывает, что экстрактивные вещества из почек, придающие розовый оттенок колориметрируемым растворам, обусловливают завышение результатов определения ланатозида С в среднем на 3,75%, что является допустимым при судебно-химических исследованиях. Желтоватый или розовый оттенок с 2,2',4,4'-тетранитродифенилом в щелочной среде не характеризует присутствия гликозидов и при получении подобной окраски количественное определение не производится.
Таким образом, фотоколориметрический метод определения сердечных гликозидов на основе реакции с 2,2',4,4'-тетранитродифенилом специфичен в присутствии экстрактивных веществ и может быть использован при исследовании тканей печени, почек, желудка и кишечника с содержимым.
Вывод
Предлагаемый новый метод фотоколориметрического определения гликозидов дигиталиса в трупном материале специфичен в присутствии экстрактивных веществ из печени, почек, желудка и кишечника с содержимым, при этом чувствительность его в 3—5 раз превышает чувствительность ранее применявшегося метода.
похожие статьи
Перспективы использования параметров окислительной модификафии белков сыворотки крови для установления длительности агонального периода / Эделев И.С., Обухова Л.М., Андриянова Н.А., Эделев Н.С. // Судебная медицина. — 2019. — №3. — С. 28-32.
Обнаружение рокурония в биологических объектах методом высокоэффективной жидкостной хроматографии/масс-спектрометрии / Матвеева А.А., Федорова К.В., Лопушанская Е.М., Киреева А.В. // Судебная медицина. — 2019. — №2. — С. 49-51.
Изучение распределения неостигмина метилсульфата в организме теплокровных животных после внутрижелудочного введения / Алехина М.И., Шорманов В.К., Никитина Т.Н., Маркелова А.М. // Судебно-медицинская экспертиза. — М., 2019. — №2. — С. 40-47.
Обнаружение 25B-NBOMe — производного фенилэтиламина в биологическом материале / Барсегян С.С., Кирюшин А.Н., Ерощенко Н.Н., Туаева Н.О., Носырев А.Е., Кирилюк А.А. // Судебно-медицинская экспертиза. — М., 2019. — №2. — С. 34-39.
Особенности распределения 2,4- и 2,6-ди-трет-бутилгидроксибензола в организме теплокровных животных / Шорманов В.К., Цацуа Е.П., Асташкина А.П. // Судебно-медицинская экспертиза. — М., 2019. — №1. — С. 36-42.