Выделение барбамила и барбитала из биологического материала с помощью метода гель-хроматографии
/ Попова В.И. // Судебно-медицинская экспертиза. — М., 1978 — №3. — С. 40-42.

Кафедра токсикологической и аналитической химии Львовского медицинского института
УДК 340.67:615.214.24:547.854.5.].074:543.544
Выделение барбамила и барбитала из биологического материала с помощью метода гель-хроматографии. Попова В.И. Суд.-мед. эксперт., 1978, № 3, с. 40-42.
Разработана методика, основанная на изолировании водой, подкисленной серной кислотой, и на последующей очистке вытяжек от примесей с помощью метода гель-хроматографии. Определены границы обнаружения и количественного определения. Таблица. 1.
ISOLATION OF BARBAMYL AND BARBITAL FROM BIOLOGICAL MATERIAL BY GEL CHROMATOGRAPHY
V. I. Popova
The technique proposed is based on isolation of the aforementioned barbiturates with H2S04—acidified water with following purification of the extracts by gel chromatography. The technique allows to isolate 39—46 per cent of barbamyl and 27—29 per cent of barbital. The murexide test detection limits for barbamyl and barbital are 2 mg and 3 mg respectively, when the barbiturates have been added to 100 g of biological material and extracted by the technique described. After storing the barbiturate-containing material for about 6 months 34—36 per cent of barbamyl and 17—21 per cent of barbital can be detected.
Для выделения барбитуратов из биологического материала применяют различные методы: Стаса-Отто (1851, 1856), А.А. Васильевой (1949), В.П. Крамаренко (1962) и др. При этом основные затруднения связаны с очисткой полученных вытяжек от примесей. При соблюдении условий очистки вытяжек все же получаются остатки, в большей или меньшей степени содержащие примеси, что не позволяет определять в них барбитураты спектрофотометрическим и другими чувствительными методами. Поэтому мы разработали новую методику выделения этих веществ, основанную на изолировании их подкисленной водой по методу В.П. Крамаренко (1962) с последующей очисткой вытяжек с помощью гель-хроматографии.
Экспериментальная часть
100 г измельченного биологического материала (печень, почки, мозг) помещали в стакан, заливали 0,02 н. раствором серной кислоты (80 мл), жидкость доводили 30% раствором серной кислоты до pH 2,0—3,0 и оставляли на 2 ч при периодическом перемешивании. После этого вытяжку сливали, материал еще 2 раза заливали новыми порциями 0,02 н. серной кислоты (по 80 мл) и каждый раз настаивали по 1 ч. Вытяжки объединяли, процеживали через 3 слоя марли и измеряли объем. Затем вытяжку центрифугировали (13 000—15 000 об/мин) в течение 20—30 мин. 50 мл (или 25 мл) отцентрифугированной вытяжки вносили в колонку (40x2,5 см), заполненную гелем сефадекса G-25 (размер частиц в сухом состоянии 100—300 мкм). На полиэтиленовой трубке в нижней части колонки открывали зажим, внесенная в колонку вытяжка впитывалась гелем (при этом над гелем всегда должен оставаться небольшой слой жидкости). После впитывания жидкости гелем в колонку дважды вносили по 2 мл 0,02 н. раствора серной кислоты (каждый раз открывая зажим, что обеспечивало полное впитывание жидкости гелем).
Для элюирования барбитуратов колонку соединяли с установленным выше сосудом, заполненным 0,02 н. раствором серной кислоты, и открывали зажим внизу колонки. Первые 150 мл элюата отбрасывали, а следующие 200 мл элюата (в котором содержатся барбитураты) переносили в делительную воронку и прибавляли, 50 мл хлороформа. Содержимое делительной воронки взбалтывали в течение 10 мин. Экстрагирование барбитуратов новыми порциями хлороформа (по 50 мл) производили еще 2 раза. Хлороформные вытяжки объединяли, выпаривали при 40°С досуха. Барбитураты определяли в сухих остатках спектрофотометрическим методом (по светопоглощению в УФ-области спектра). Для этого сухой остаток растворяли в 25 мл 0,3 н. раствора едкого натра, затем прибавляли 75 мл насыщенного раствора буры и измеряли оптическую плотность полученных растворов с помощью спектрофотометра СФ-4А (кювета 1 см). Оптическую плотность раствора барбамила измеряли при длине волны 239 нм барбитала — при длине волны 240 нм Расчет содержания выделенных
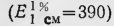
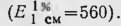
а оптическую плотность раствора, производили по формуле:
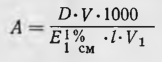
где А—количество барбитурата в пробе (в мг); D — оптическая плотность; Е 1% 1см— удельный показатель поглощения исследуемого барбитурата; I — толщина слоя жидкости в кювете (в см); V — общий объем вытяжки (в мл); V1 — объем вытяжки, пропущенной через гель сефадекса (в мл).
Исследования показали, что при содержании 40 мг барбитуратов; в 100 г биологического материала можно выделить 39—46% барбамила и 27—29% барбитала.
Кроме того, провели опыты по выделению указанных барбитуратов из биологического материала другими методами (В.И. Попова, 1967; В.И. Попова и В.П. Крамаренко, 1970). Количественное определение барбитуратов, выделенных методами Стаса-Отто, А.А. Васильевой, В.Ф. Крамаренко, а также Валова, производили фотоэлектроколо-риметрическим методом, основанным на реакции взаимодействия барбитуратов с ацетатом кобальта и изопропиламином. Очистку выделенных барбитуратов проводили с помощью вольфрамата натрия (Валов, 1946).
Результаты выделения барбамила и барбитала различными методами приведены в таблице.
Мы установили также границы обнаружения и количественного определения барбамила и барбитала.
Выделение барбитуратов различными методами
| Выделено барбитурата (в %) методом | |||||
|---|---|---|---|---|---|
| Барбитурат | Стаса-Отто | А.А. Васильевой | В.П. Крамаренко | Валова | предложенным автором |
| Барбамил
Барбитал | 44—46
21—23 | 18—20
13—14 | 6—7
19—20 | 32—37
25—26 | 39—46
27—29 |
Для этого к 100 г измельченной печени прибавляли водные растворы, содержащие различные количества соответствующих препаратов (2, 3, 5, 10, 20, 40 и 50 мг). Смеси оставляли на сутки при периодическом перемешивании, барбитураты выделяли по указанной выше методике.
Для идентификации барбитуратов применяли мурексидную реакцию. Сухие остатки растворяли в 2 мл хлороформа и растворы переносили в фарфоровые чашки. Хлороформ выпаривали на водяной бане досуха. К сухим остаткам прибавляли по 3 капли перекиси водорода и по 3 капли реактива*. Смеси выпаривали досуха на небольшом пламени газовой горелки, а затем продолжали нагревание сухих остатков до появления белых паров. Полученные сухие остатки охлаждали и прибавляли по 3 капли 6 н. раствора аммиака. В присутствии барбамила и барбитала появлялось розовое окрашивание. Этой реакции не дают гексенал, гексобарбитал и циклобарбитал.
Для идентификации барбитуратов при помощи методов хроматографии в тонком слое сорбента и газожидкостной хроматографии сухие остатки растворяли в 1 мл ацетона. Ацетоновые растворы упаривали до получения небольших объемов (0,5 мл). Для исследования барбитуратов методом газожидкостной хроматографии брали по 5 мкл указанных растворов и вводили в хроматограф. Остальную часть ацетоновых растворов барбитуратов использовали для обнаружения их с помощью метода хроматографии в тонком слое силикагеля КСК
Количественное содержание каждого барбитурата определяли спектрофотометрически, как указано выше.
Проведенные исследования показали, что с помощью метода, основанного на измерении светопоглощения барбитуратов в УФ-области спектра, в 100 г биологического материала можно определить около 5 мг барбитуратов.
При помощи мурексидной реакции можно обнаружить 2 мг барбамила и 3 мг барбитала, прибавленных к 100 г биологического материала и выделенных с помощью предлагаемой нами методики.
Методом хроматографии в тонком слое силикагеля КСК и методом газожидкостной хроматографии можно обнаружить 2 мг барбамила и 2 мг барбитала в 100 г биологического материала.
Проведенные нами опыты по выделению барбамила и барбитала из гнилостно-разложившегося материала показали необходимость дополнительной очистки полученного хлороформного извлечения. Для этого хлороформное извлечение, содержащее барбитурат, взбалтывали 2 раза (по 25 мл в течение 5—7 мин) с 0,1% раствором едкого натра.
Затем водную вытяжку подкисляли 30% раствором серной кислоты до pH 2,0—3,0 и барбитураты экстрагировали хлороформом 3 раза (по 50 мл в течение 10 мин). Хлороформные извлечения объединяли, взбалтывали с сульфатом натрия (5—7 г) и выпаривали досуха. В сухих остатках определяли барбитураты.
Исследования показали, что после 6-месячного хранения биологического материала, содержащего барбитураты, определяется 34—36% барбамила и 17—21% барбитала.
Выводы
- Разработана методика выделения барбамила и барбитала из биологического материала, основанная на изолировании этих веществ водой, подкисленной серной кислотой, и на последующей очистке вытяжек от примесей с помощью метода гель-хроматографии.
- По указанной методике выделяется из биологического материала 39—46% барбамила и 27—29% барбитала.
- Граница обнаружения при использовании мурексидной реакции для барбамила составляет 2 мг, для барбитала — 3 мг (прибавленных к 100 г материала и выделенных по предлагаемой методике).
- Граница количественного определения спектрофотометрическим методом (УФ-область) составляет 5 мг барбамила и барбитала (прибавленных к 100 г материала).
- При хранении около 6 мес биологического материала, содержащего барбитураты, определяется 34—36% барбамила и 17—21% барбитала.
* К 1 г соли Мора (NH4)2Fe (SO4)2.6H2O прибавляли 0,5 мл соляной кислоты (удельный вес 1,12) и воду до 100 мл. К 5 мл этого раствора добавляли 4 г хлорида аммония и воду до 100 мл. Полученную жидкость использовали в качестве реактива.
похожие статьи
Перспективы использования параметров окислительной модификафии белков сыворотки крови для установления длительности агонального периода / Эделев И.С., Обухова Л.М., Андриянова Н.А., Эделев Н.С. // Судебная медицина. — 2019. — №3. — С. 28-32.
Обнаружение рокурония в биологических объектах методом высокоэффективной жидкостной хроматографии/масс-спектрометрии / Матвеева А.А., Федорова К.В., Лопушанская Е.М., Киреева А.В. // Судебная медицина. — 2019. — №2. — С. 49-51.
Изучение распределения неостигмина метилсульфата в организме теплокровных животных после внутрижелудочного введения / Алехина М.И., Шорманов В.К., Никитина Т.Н., Маркелова А.М. // Судебно-медицинская экспертиза. — М., 2019. — №2. — С. 40-47.
Обнаружение 25B-NBOMe — производного фенилэтиламина в биологическом материале / Барсегян С.С., Кирюшин А.Н., Ерощенко Н.Н., Туаева Н.О., Носырев А.Е., Кирилюк А.А. // Судебно-медицинская экспертиза. — М., 2019. — №2. — С. 34-39.
Особенности распределения 2,4- и 2,6-ди-трет-бутилгидроксибензола в организме теплокровных животных / Шорманов В.К., Цацуа Е.П., Асташкина А.П. // Судебно-медицинская экспертиза. — М., 2019. — №1. — С. 36-42.