Определение типов гаптоглобина в жидкой крови при горизонтальном электрофорезе в крахмальном геле
/ Старостин Н.Н. // Судебно-медицинская экспертиза. — М., 1966 — №3. — С. 34-37.

УДК 340.424.412:616.153.963.1
Кафедра судебной медицины (зав. — доц. Л.И. Иванников) Крымского медицинского института, Симферополь
Поступила в редакцию 1/III 1965 г.
Гаптоглобин (условное обозначение Нр) является составной частью фракции α2-глобулинов сыворотки крови. Он образует с гемоглобином комплексное соединение и имеет относительно высокую пероксидазную активность, что и было использовано для его определения.
Существует 3 основных типа гаптоглобина. Нр 1-1 соответствует группе сыворотки I и имеет только одну гаптоглобиновую фракцию, передвигающуюся непосредственно перед фракцией свободного (избыточного) гемоглобина. Гаптоглобиновые типы Нр 2-2 и Нр 2-1 соответствуют группам сыворотки IIВ и IIА. Нр 2-2, кроме фракции свободного гемоглобина, имеет до 4 гемоглобинсвязывающих фракций, расположенных в области αβ-глобулинов. Нр 2-1 имеет непосредственно за βc-глобулинами обособленную фракцию, а в области αβ-глобулинов отмечается до 6 гаптоглобиновых полосок. Следовательно, Нр 1-1 имеет величину миграции, примерно одинаковую с гемоглобином, Нр 2-1 мигрирует наиболее далеко, Нр 2-2 занимает промежуточное положение (рис. 1).
Гаптоглобин стоек к внешним воздействиям, не связан с изосерологическими системами, передается по наследству. Последнее свойство широко используют в экспертизах о спорном материнстве или отцовстве.
Гаптоглобин можно определять йодометрическим и электрофоретическим методами. Первый позволяет установить общее количество гаптотлобина, а второй — тип его. Мы использовали горизонтальный электрофорез в крахмальном геле по Smithies в модификации Prokop с сотрудниками. Учитывая известные трудности в освоении указанной методики, мы предлагаем внести некоторые уточнения, позволяющие получить более стабильные результаты.
Наши исследования не подтвердили указания о пригодности только определенных сортов крахмала. Лучшим оказался аптечный картофельный крахмал, — по-видимому, более чистый химически.
Порцию картофельного крахмала 250 г просушивают 1—2 суток при 40°, гидролизуют без взбалтывания в 400 мл очищенного ацетона в смеси с 20 мл 25% раствора соляной кислоты в течение 20 мин. при 40°. Предварительно ацетон в смеси с соляной кислотой выдерживают при 40° не менее 12 часов. Важно поддерживать постоянную температуру при гидролизе (суховоздушный электрический термостат 2Ц-450 повышенной точности: ±0, 3°). По истечении указанного срока ацетон по возможности сливают и при отсутствии воронки Бюхнера крахмал промывают 8—10 л дистиллированной воды до нейтральной реакции. В качестве нейтрализатора можно применять 150 мл 1М раствора ацетата натрия. Крахмал обезвоживают в 300 мл ацетона, высушивают при 40° и развешивают по 39 г.
Можно использовать буферные растворы следующих составов: 1) борной кислоты 0, 93 г, едкого натра 0,66 г, дистиллированной воды до 1 л, перед употреблением добавить дистиллированной воды 1:1; ионная сила 6, 05, pH 11,0; 2) борной кислоты 9, 3 г, едкого натра 1,3 г, дистиллированной воды до 1 л; ионная сила 0, 93, pH 9, 0.
Исследуемую сыворотку отделяют от эритроцитов центрифугированием (гемолиз не оказывал существенного влияния на качество исследования). Ее соединяют с гемоглобином: 10 капель сыворотки + 1 капля раствора гемоглобина, ибо физиологическое содержание гемоглобина в сыворотке (1—3 мг%) недостаточно для отчетливого выявления типов гаптоглобина. Для получения гемоглобина эритроциты до 10 раз промывают физиологическим раствором до полного удаления сыворотки и добавляют троекратное количество дистиллированной воды. Полученный раствор гемоглобина фильтруют и сохраняют при 2—5° (при указанных условиях гемоглобина сохраняется до 1,5 месяцев). Относительно длительное хранение исследуемой сыворотки, замораживание, появление признаков гниения не оказывали существенного влияния на результаты установления типов гаптоглобина.
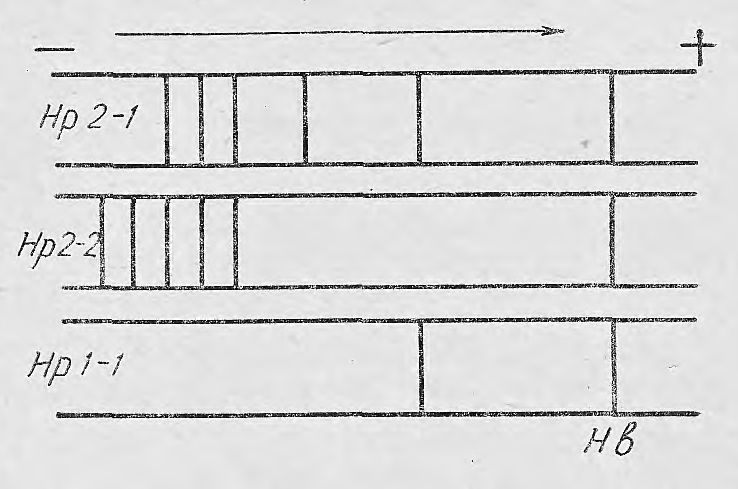
Рис. 1. Фракция типов гаптоглоби-на, ближайшая к аноду фракция свободного гемоглобина.
От 300 мл крахмального буферного раствора отливают 39 мл. Из полученного количества 200 мл буферного раствора помещают в сосуд для заваривания крахмала, а остаток — в делительную воронку, в которую предварительно высыпают 39 г гидролизованного крахмала и взбалтывают. Этот раствор нагревают до кипения и при энергичном помешивании добавляют взвешенный в буферном растворе крахмал равномерной струей через отверстие (обычный диаметр 0, 2 см) в пробке делительной воронки. При этом получают 13% гель, что обеспечивает более убедительные результаты. Через фильтр (обычную чулочную капроновую ткань) горячий гель выливают в плоскую плексигласовую кювету (размер 13X18X1,7 см), на дно которой предварительно помещают'Стеклянную пластинку (толщиной 2—3 мм); расплавленный гель для предотвращения испарения закрывают аналогичным стеклом. Следя за тем, чтобы высота геля была одинаковой после того, как он остынет (станет упруго-эластичным), гелевый блок извлекают и, перевернув нижней поверхностью вверх (в ней меньше пузырей), специально отточенным обоюдоострым скальпелем, под контролем линейки, через равные промежутки делают сквозные разрезы длиной до 1 см, куда вводят пропитанные исследуемой сывороткой полоски фильтровальной бумаги (размер 1X1,5 см). Затем блок помещают в рабочую плексигласовую камеру (рис. 2), дно которой должно быть максимально тонким, что необходимо для уменьшения расстояния между нижним уровнем блока и электродным буферным раствором (для уменьшения сопротивления). На края гелевого крахмального блока накладывают полоски фильтровальной бумаги (несколько слоев) шириной до 13 см, свободные концы ее опускают в буферный раствор, налитый по 200 мл в 2 ванночки. Электродный буферный раствор после опыта выливают и заменяют свежим. Постоянный ток подают через платиновые электроды от выпрямителя ПЭФ-1 (можно использовать другие аппараты, дающие постоянный ток среднего напряжения). Лучше применять рабочую камеру, где возможен непосредственный контакт электродного буфера с гелевым блоком (рис. 3). Аппарат аналогичной конструкции описан И.М. Маркеловым1.
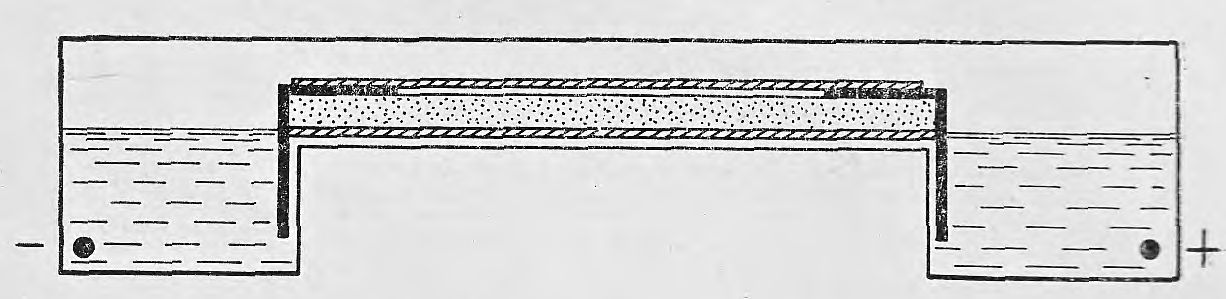
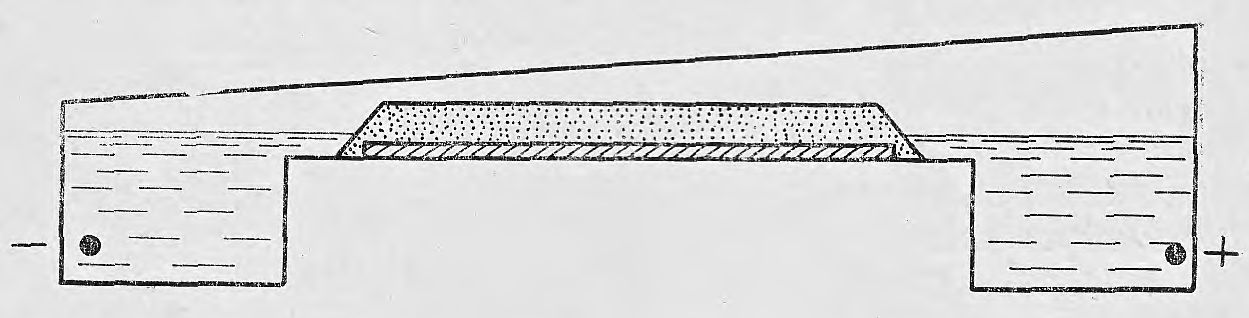
Рис. 2. Камера для горизонтального электрофореза (контакт между крахмальным блоком и электродным буферным раствором осуществляют полосками фильтровальной бумаги).
Рис. 3. Камера для горизонтального электрофореза (непосредственный контакт между блоком и электродным буферным раствором).
Для получения стабильных результатов важно, кроме правильного проведения гидролиза крахмала, в процессе электрофореза поддерживать постоянную силу тока (в среднем до 30 ма), что достигается небольшим периодическим изменением напряжения. (Напряжение при указанных условиях опыта не превышает 150 в. ) Через 10—15 мин. после начала опыта фильтровальные бумажки извлекают (форез можно не прерывать), а через 2—3 часа, когда гаптоглобины полностью разделятся, крахмальный блок извлекают и разрезают туго натянутой проволокой с круглым сечением (диаметр не более 1—1,5 мм) на уровне средней трети, где наблюдается оптимальное разделение гаптоглобинов. На поверхности разрезов 2 половин блока накладывают полоски фильтровальной бумаги, через которые производят окрашивание гаптоглобинов. Реактив Smithies: 100 мл воды, 0, 5 мл ледяной уксусной кислоты, 0, 2 г бензидина и 0, 2 мл 30% раствора перекиси водорода. Хороший результат дает реактив, состоящий из 1 г бензидина, 4 г пероксида бария (для однократного пользования берут 0, 1—0, 2 г указанного порошка и растворяют в 10 мл 50% раствора уксусной кислоты). Для окрашивания 2 половин блока вполне достаточно 10 мл реактива, приготовленного непосредственно перед употреблением. Гаптоглобины окрашиваются в светло-голубой цвет. Результаты учитывают в течение первых 5—10 мин. По истечении указанного срока без консервации контуры полос фракций гаптоглобина становятся нечеткими и цвет их меняется. Фотографирование производят аппаратом «Зенит» на пленке «Микрат-300».
Введение в практику судебной медицины зонального электрофореза для определения типов гаптоглобина имеет большое значение.
1 Лабораторное дело, 1964, № 6, с. 372.
похожие статьи
Определение групповой принадлежности изолированных клеток влагалищного эпителия / Локтева Р.В., Локтев А.И., Шишкина Ж.А., Курзин Л.М. // Избранные вопросы судебно-медицинской экспертизы. — Хабаровск, 2022. — №21. — С. 78-82.
Использование методики окрашивания препаратов раствором акридинового оранжевого при определении групповой принадлежности изолированных клеток с помощью реакции смешанной агглютинации / Локтева Р.В., Королева М.В., Панасенко С.В., Курзин Л.М. // Избранные вопросы судебно-медицинской экспертизы. — Хабаровск, 2022. — №21. — С. 73-78.
Метод избирательной абсорбции при определении кровяных групп в кровяных пятнах / Серебряников П. // Судебно-медицинская экспертиза. — М.: Изд-во Наркомздрава, 1928. — №8. — С. 3-7.
Судебно-медицинские экспертизы и исследования вещественных доказательств биологического происхождения в России (по материалам 2003—2017 гг.) / Ковалев А.В., Куприна Т.А., Самоходская О.В., Кондратова И.В. // Судебно-медицинская экспертиза. — М., 2018. — №6. — С. 29-32.
Обнаружение эклипсных антигенов в трупной крови / Локтева Р.В. // Избранные вопросы судебно-медицинской экспертизы. — Хабаровск, 2019. — №18. — С. 127-131.