Изолирование, обнаружение и определение прозерина в трупном материале
/ Зимнухов В.В. // Судебно-медицинская экспертиза. — М., 1967 — №4. — С. 35-40.

УДК 340. 67: 615. 785.4
В.В. Зимнухов
Карагандинское областное бюро судебно-медицинской экспертизы (нач. В.И. Куриннов)
ISOLATION, DETECTION AND ESTIMATION OF PROSERINE IN CADAVERIC MATTER
V. V. Zimnuhov
Proserine is extracted from aqueous solution saturated with potassium carbonate after isolation with acidated alcohol. The extract is purified by paper chromatography. Detection by microcrystalline reactions (Reinecke’s salt, complex ferrum rhodanide, solution of plumbic iodide in potassium iodide and sodium thiosulphate) is recommended. Proserine is estimated by photocolorimetric proceeding. Detection range is 100 micrograms, estimation range: 200 micrograms.
Прозерин (диметилкарбаминовый эфир метилсульфата мета-окси-фенил-триметиламмония) применяют при лечении многих заболеваний нервной системы, для стимулирования родовой деятельности, для снижения внутриглазного давления.
Препарат является сильнодействующим веществом и обладает высокой токсичностью. Известны случаи отравления им.
Однако методы исследования трупного материала на наличие прозерина до сих пор не разработаны.
Мы поставили перед собой задачу разработать метод изолирования, обнаружения и определения прозерина в трупном материале.
Экспериментальная часть
Изолирование прозерина. Прозерин не извлекается хлороформом и другими не смешивающимися с водой органическими растворителями ни из кислых, ни из щелочных растворов и не может быть выделен общепринятыми методами изолирования алкалоидов и многих других, важных в судебно-химическом отношении органических веществ.
Мы отметили, что прозерин можно извлечь хлороформом из водных растворов, насыщенных карбонатом калия.
Опытами с чистым препаратом установили, что при этом для наиболее полного извлечения число экстрагирований должно быть не менее 5 и каждое должно продолжаться 5 мин. при энергичном встряхивании.
При концентрации прозерина 0, 5 мг на 50 мл раствора полнота извлечения составляет 95%. С увеличением концентрации полнота извлечения возрастает.
Способность прозерина извлекаться хлороформом из насыщенных карбонатом калия растворов мы использовали для изолирования его из трупного материала. При этом прозерин извлекали этиловым спиртом с добавлением винной кислоты. По испарении спирта остаток обрабатывали водой. Из водного раствора после насыщения карбонатом калия прозерин экстрагировали хлороформом. Полученные экстракты обычно загрязнены балластными веществами, особенно при исследовании загнившего трупного материала. Поэтому обнаружение я определение прозерина производили после дополнительной очистки, для которой применяли восходящий метод бумажной хроматографии. Пользовались хроматографической бумагой марки «М» и электрофорезной быстрой FN-11 (ГДР) и системой растворителей: н-бутанол, насыщенный 10% водным раствором соляной кислоты. Хроматограммы проявляли парами йода, под действием которых в месте нахождения прозерина на хроматограмме образуется окрашенный комплекс прозерина с йодом. В зависимости от концентрации прозерина окраска может быть от желтой до темно-коричневой. При обработке хроматограмм парами аммиака комплекс разрушается, и пятно обесцвечивается. Выделившийся при этом прозерин может быть элюирован, доказан микрокристаллическими реакциями и определен.
Описанным методом достигается достаточно полная очистка изолированного прозерина.
Ранее мы разработали микрокристаллические реакции на прозерин с солью Рейнеке, раствором йодида свинца в йодиде калия и тиосульфате, комплексным роданидом железа, раствором йода в йодиде калия и реактивом Майера. Для обнаружения прозерина в трупном материале мы отобрали 3 первые как наиболее специфичные и легко воспроизводимые. Результаты реакций зависят от чистоты изолированного прозерина. Балластные вещества замедляют реакцию, снижают чувствительность, искажают форму кристаллов. Реакция с солью Рейнеке удается только после очистки остатка. При обнаружении прозерина в загрязненном остатке реакцией с раствором йодида свинца в йодиде калия и тиосульфате натрия образуются бесцветные колосистые сростки, обычно кристаллизующиеся по краям капли. В сильно загрязненном препарате образуются бесформенные глыбки. На форму кристаллов, получаемых при реакции с комплексным роданидом железа, балластные вещества не влияют, но при этом замедляется кристаллизация и понижается чувствительность. После предварительной очистки прозерин, выделенный из трупного материала, образует с указанными выше реактивами кристаллы такой же формы, как чистый препарат при тех же реакциях.
Для количественного определения прозерина мы разработали фотоколориметрический метод, основанный на реакции образования азокраски. Сущность его заключается в том, что в результате взаимодействия прозерина с едким натром при нагревании образуется соединение фенольного характера, которое, сочетаясь с диазотированной сульфаниловой кислотой, дает азокраситель от оранжевого до вишнево-красного цвета.
Экспериментально установили, что интенсивность окраски зависит от количества прозерина, взятого для реакции. Оптическую плотность окрашенных растворов измеряли на фотоэлектроколориметре ФЭК-М. При этом использовали синий светофильтр (420 ммк) и кюветы с рабочей длиной 3, 072 мм.
Для построения калибровочного графика (см. рисунок) использовали 0, 005% водный раствор прозерина, приготовленный из препарата, отвечающего требованиям ГФIХ, и высушенного при температуре 70° до постоянного веса. В фарфоровую чашку вносили определенный объем такого раствора (из расчета 0, 05—0, 5 мг препарата с интервалом 0, 05 мг) и доводили водой до 10 мл. Добавляли 1 мл 5% раствора едкого натра и смесь нагревали на парафиновой бане при температуре 140° до получения сухого остатка. Последний нагревали еще 5 мин. при той же температуре и охлаждали в эксикаторе до комнатной температуры. Затем остаток растворяли в 2 мл воды при помешивании стеклянной палочкой. Добавляли 1 мл 0,2% раствора сульфаниловой кислоты, 1 мл 5% раствора нитрита натрия и 0,1 мл 18% соляной кислоты. Окрашенный раствор отделяли от осадка центрифугированием, переносили в кювету и измеряли оптическую плотность. Для сравнения использовали воду.
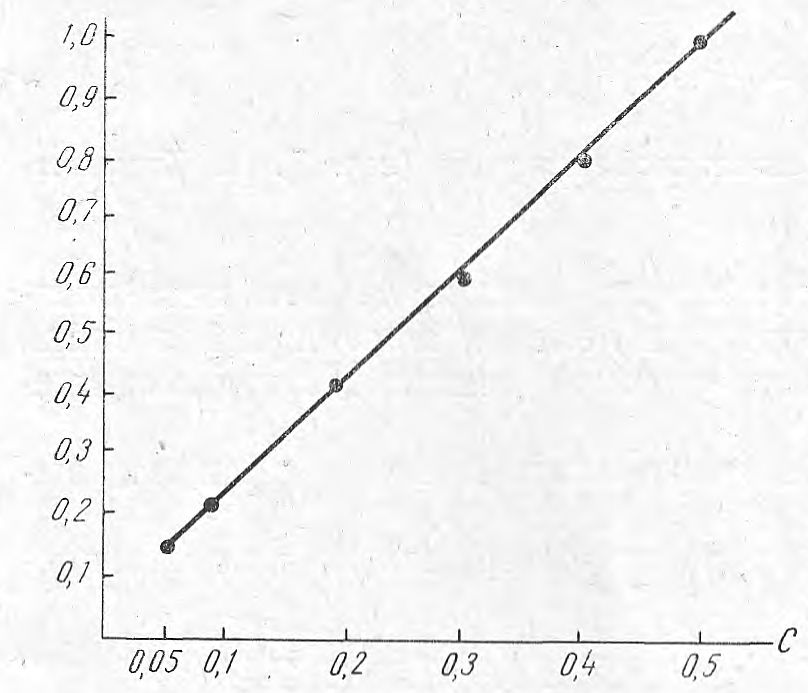
Калибровочный график для определения прозерина (светофильтр А, 420 ммк, кювета с рабочей длиной 3,072 мм).
В указанных условиях закон Ламберта — Бугера — Бера соблюдается. Интенсивность окраски достигает максимума через 5 мин. и сохраняется в течение нескольких часов.
Мы проводили опыты по изолированию, обнаружению и определению прозерина на искусственных смесях. К пробам измельченного трупного материала добавляли определенное количество прозерина. Через 2 суток пробы исследовали.
Граница обнаружения прозерина микрокристаллическими реакциями с солью Рейнеке и комплексным роданидом железа составила 180 мкг в 100 г трупного материала, а с раствором йодида свинца в йодиде калия и гипосульфите натрия — 100 мкг. Результаты количественного определения прозерина приведены в табл. 1, из которой видно, что при содержании 1, 5 мг прозерина в 100 г трупного материала в среднем определяется 64,8%. С уменьшением концентрации прозерина результаты ухудшаются, и при содержании 0, 2 мг в 100 г трупного материала определяется только 30% прозерина.
Таблица 1
Определение прозерина, добавленного к трупному материалу (печень)
|
Добавлено прозерина (в мг) |
Найдено прозерина |
Добавлено прозерина (в мг) |
Найдено прозерина | ||
|
в мг |
В % |
в мг |
в % | ||
|
1,5 |
0,96 |
64 |
0, 4 |
0, 185 |
46, 25 |
|
1,5 |
0,99 |
66 |
0, 4 |
0, 22 |
55 |
|
1,5 |
0,97 |
64, 6 |
0, 4 |
0, 17 |
42, 5 |
|
М |
64,86% |
47, 91 % | |||
|
1,0 |
0,6 |
60 |
0, 2 |
0, 055 |
27, 5 |
|
1,0 |
0,49 |
49 |
0, 2 |
0, 075 |
37, 5 |
|
1,0 |
0,56 |
56 |
0, 2 |
0, 05 |
25 |
|
М |
55% |
30% | |||
Таблица 2
Определение прозерина, введенного под кожу собаке
|
Органы, подвергшиеся исследованию |
Навеска органов (в г) |
Найдено прозерина (в мг) |
|
Печень |
100 |
0,25 |
|
Почка |
70 |
0,3 |
|
Вещество головного мозга |
65 |
Не найдено |
В контрольных опытах при проявлении хроматограммы окрашенные пятна не проявлялись.
Мы провели также опыты по исследованию внутренних органов отравленного животного. Собаке весом около 13 кг ввели под кожу 15 мг прозерина (3 мл 0,5% раствора). Через 3 мин. появились признаки отравления, а через 10 мин. собака погибла. Для исследования взяли печень, почки и мозг. Обнаружили прозерин в печени и почке всеми микрокристаллическими реакциями. При этом отклонений формы кристаллов не наблюдали ни в одном случае.
Результаты количественного определения прозерина приведены в табл. 2.
В практической работе мы встретили случай отравления прозерином и разработанной методикой доказали наличие прозерина и определили его количество.
Гр-ке О. с целью прерывания беременности ветеринарный фельдшер ввел внутримышечно раствор прозерина неустановленной концентрации. Через несколько минут у гр-ки О. появилось головокружение, началось выделение пенистой жидкости изо рта и носа, а затем наступила потеря речи. В бессознательном состоянии пострадавшая поступила в больницу, где, несмотря на принятые меры, через 2 часа скончалась.
На исследование были доставлены печень, почка, мозг, мочевой пузырь (в одной банке), участок мышцы с подкожной клетчаткой с места инъекции прозерина, кровь и желудок с кишечником. Прозерин был обнаружен всеми микрокристаллическими реакциями в печени, почке, а также в мышце с подкожной клетчаткой. Во всех случаях были получены характерные кристаллы. При количественном определении в 170 г мышц с подкожной клетчаткой найдено 5, 2 мг прозерина. В печени и почке количественное определение прозерина не проводили.
Методика исследования трупного материала на прозерин
100 г тщательно измельченного трупного материала переносят в центрифужный стакан и производят трехкратное повторное извлечение 100 мл порциями 1% раствора винной кислоты в 95° этиловом спирте. 1-е извлечение продолжают 2 часа, 2-е и 3-е — 1,5 часа. Спиртовые вытяжки отделяют центрифугированием (2000 об/мин. ) в течение 20 мин., объединяют и оставляют на сутки в закрытой колбе. Через сутки выпавший осадок балластных веществ отделяют центрифугированием, промывают небольшим количеством спирта, который присоединяют к центрифугату. Последний выпаривают на водяной бане при температуре не выше 60° до объема около 5 мл. Остаток в чашке смешивают с 20 мл воды и фильтруют через небольшой складчатый фильтр, смоченный водой. Чашку и фильтр несколько раз промывают водой, промывные воды присоединяют к фильтрату. Собирают около 50 мл водного раствора.
Водный раствор для очистки извлекают хлороформом 3 раза из кислой среды и 2 раза из щелочной (подщелачивают раствор безводным поташом до pH около 9 по универсальной индикаторной бумажке, поташ добавляют осторожно во избежание бурного вспенивания). Затем раствор насыщают в колбе безводным поташом, добавляя последний не менее 12 г на каждые 10 мл.
Колбу периодически охлаждают водой. Насыщенный раствор дважды взбалтывают с эфиром. Эфирные извлечения отбрасывают, а прозерин экстрагируют хлороформом при энергичном встряхивании (20 мл порциями 5 раз по 5 мин.). В случае образования устойчивой эмульсии последнюю расслаивают центрифугированием. Хлороформные извлечения объединяют и фильтруют через небольшой фильтр, смоченный хлороформом. После отслаивания хлороформ занимает верхний слой в делительной воронке, поэтому его удобнее сливать через верхнее отверстие.
Хлороформ испаряют при температуре не выше 60°. Остаток многократно обрабатывают небольшими порциями хлороформа и наносят в виде сплошной полосы шириной не более 1 см на хроматографическую бумагу на расстоянии 3 см от нижнего конца и 2 см от боковых сторон. В зависимости от величины остатка длину полосы меняют от 5 до 8 см. Бумагу помещают нижним концом в н-бутанол, насыщенный 10% водным раствором соляной кислоты и оставляют в закрытой камере на 17—20 часов. По окончании хроматографирования бумагу высушивают при температуре не выше 60° и помещают на 5 мин. в герметически закрывающийся сосуд, насыщенный парами йода. Окрашенный участок бумаги вырезают и помещают в камеру, насыщенную парами аммиака до обесцвечивания. После обесцвечивания бумагу оставляют в камере еще на 20 мин. Затем бумагу тщательно измельчают ножницами и переносят в центрифужную пробирку. Прозерин элюируют водой. Для этого измельченную бумагу в течение часа настаивают с 6 мл воды при периодическом помешивании стеклянной палочкой. Элюат отделяют центрифугированием, а бумагу в пробирке настаивают еще 2 раза по 15 мин. с 2 мл воды. Элюаты объединяют и доводят водой до 10 мл. 4 мл элюата выпаривают досуха при температуре не выше 60°. Сухой остаток обрабатывают хлороформом. Хлороформный раствор наносят на предметные стекла.
По испарении хлороформа с остатками проводят микрокристаллические реакции. Для проведения реакций с раствором йодида свинца в йодиде калия и гипосульфите натрия, а также с комплексным роданидом железа реактивы наносят на сухие остатки. При выполнении реакции с солью Рейнеке остатки растворяют в капле 0,1 н. соляной кислоты или капле воды.
В оставшейся части элюата определяют количество прозерина. Элюат переносят в фарфоровую чашку, доводят водой до 10 мл и далее поступают как при построении калибровочного графика.
Иногда после испарения хлороформного извлечения, особенно при исследовании загнившего материала, остатки получаются большими. В таких случаях перед хроматографированием остаток в чашке обрабатывают 5 раз небольшими порциями воды (около 2 мл). Водные растворы фильтруют через небольшой ватный тампон, выпаривают при температуре не выше 60°. Остаток наносят на хроматографическую бумагу и исследование продолжают как указано выше.
Сохраняемость прозерина в трупном материале. Для выяснения сохраняемости прозерина к 100 г печени добавляли по 1, 5 мг прозерина. Материал хранили при температуре 18—20° и исследовали через 10, 20 и 30 дней. Параллельно ставили контрольные опыты. Во всех случаях прозерин был обнаружен всеми микрокристаллическими реакциями. При этом изменений в форме кристаллов не наблюдалось. Результаты количественного определения приведены в табл. 3.
Таблица 3
Сохраняемость прозерина в трупном материале
| Время хранения (в днях) | Добавлено прозерина (в мг) | Найдено | прозерина |
| в мг | в. % | ||
| 10 | 1,5 | 0,89 | 59,3 |
| 10 | 1,5 | 0,84 | 56 |
| 10 | 1,5 | 0,77 | 51,3 |
| М | 55,53% | ||
| 20 | 1,5 | 0,73 | 48,6 |
| 20 | 1,5 | 0,67 | 44,6 |
| 20 | 1,5 | 0,79 | 52,6 |
| М | 48,6% | ||
| 30 | 1,5 | 0,66 | 44 |
| 30 | 1,5 | 0,49 | 32,66 |
| 30 | 1,5 | 0,71 | 47,3 |
| М | 41,32% |
Из приведенных данных видно, что прозерин довольно стойкое соединение, и при наличии 1, 5 мг его в 100 г трупного материала он может быть открыт и определен после месячного хранения при комнатной температуре.
Одной из причин ухудшения результатов определения является наличие балластных веществ, содержание которых заметно повышается при усилении процессов гниения.
В контрольных опытах при проявлении хроматограммы окрашенные участки не обнаружены.
Реакция взаимодействия прозерина с парами йода обладает высокой чувствительностью, поэтому отсутствие окрашивания на проявленной хроматограмме указывает на отсутствие прозерина.
Выводы
1. Разработан метод исследования трупного материала на прозерин. Для изолирования прозерина использована способность его экстрагироваться хлороформом из водных растворов, насыщенных поташом. Для очистки экстрактов применен метод бумажной хроматографии.
2. Для обнаружения прозерина применены микрокристаллические реакции с раствором йодида свинца в йодиде калия и тиосульфате натрия, комплексным роданидом железа, солью Рейнеке. Прозерин, выделенный из трупного материала, после хроматографической очистки дает со всеми указанными реактивами кристаллы такой же формы, как чистый препарат при тех же реакциях.
Граница обнаружения прозерина реакцией с раствором йодида свинца в йодиде калия и тиосульфате натрия составила 100 мкг, с солью Рейнеке и комплексным роданидом железа — 180 мкг.
3. Для количественного определения использован фотоэлектроколориметрический метод. Граница определения составила 200 мкг.
4. Исследованием органов собаки, отравленной прозерином, и исследованием экспертного материала показана возможность применения разработанного метода для судебно-химических целей.
5. Проведены опыты по сохраняемости прозерина в трупном материале. Прозерин, добавленный в количестве 1,5 мг в 100 г трупного материала, может быть обнаружен и определен после месячного хранения при комнатной температуре.
Поступила в редакцию 10/III 1966 г.
похожие статьи
Перспективы использования параметров окислительной модификафии белков сыворотки крови для установления длительности агонального периода / Эделев И.С., Обухова Л.М., Андриянова Н.А., Эделев Н.С. // Судебная медицина. — 2019. — №3. — С. 28-32.
Обнаружение рокурония в биологических объектах методом высокоэффективной жидкостной хроматографии/масс-спектрометрии / Матвеева А.А., Федорова К.В., Лопушанская Е.М., Киреева А.В. // Судебная медицина. — 2019. — №2. — С. 49-51.
Изучение распределения неостигмина метилсульфата в организме теплокровных животных после внутрижелудочного введения / Алехина М.И., Шорманов В.К., Никитина Т.Н., Маркелова А.М. // Судебно-медицинская экспертиза. — М., 2019. — №2. — С. 40-47.
Обнаружение 25B-NBOMe — производного фенилэтиламина в биологическом материале / Барсегян С.С., Кирюшин А.Н., Ерощенко Н.Н., Туаева Н.О., Носырев А.Е., Кирилюк А.А. // Судебно-медицинская экспертиза. — М., 2019. — №2. — С. 34-39.
Особенности распределения 2,4- и 2,6-ди-трет-бутилгидроксибензола в организме теплокровных животных / Шорманов В.К., Цацуа Е.П., Асташкина А.П. // Судебно-медицинская экспертиза. — М., 2019. — №1. — С. 36-42.