Экстракционно-спектрофотометрическое определение пахикарпина
/ Карташова Л.Х., Конюшко В.С. // Судебно-медицинская экспертиза. — М., 1968 — №2. — С. 37-40.

УДК 615.787-079.6:543.42
Л.X. Карташова, Б.С. Конюшко
Витебский медицинский институт
Для экстракция пахикарпина гидройодида можно пользоваться красителями: бром феноловым синим, бромтимоловым синим, бромкрезоловым зеленым, бромхлорфеноловым синим, крезоловым красным, бромкрезоловым (пурпурным, бензопурпурином и метилоранжем. Спектры поглощения хлороформных экстрактов пахикарпина с бромфеноловым синим при pH 9,0 имеют 2 максимума поглощения (420 и 610 ммк). Разработана методика избирательного определения пахикарпина в биологических объектах экстракционно-спектрофотометрическим методом, основанная на экстракции с бромфеноловым синим при pH 9,0.
Таблиц 2. Иллюстраций 3.
Extraction and Spectrophotometric Estimation of Pachicarpin
Kartashova L.H., Konyushko V.S.
Поступила в редакцию 6/II 1967 г.
Исследование алкалоидов является одним из наиболее сложных и недостаточно разработанных разделов судебно-химического анализа. В частности, мало изучен пахикарпин гидройодид.
Мы изучали экстрагируемость с различными кислотными красителями — крезоловым красным, метилоранжем, бензопурпурином, бромкрезоловым пурпурным, бромхлорфеноловым синим, бромфеноловым синим, бромтимоловым синим, бромкрезоловым зеленым при pH от 1, 0 до 12, 0 по следующей методике: к 1 мл 0,004 М раствора пахикариина гидройодида добавляли 2 мл 0, 004 М раствора красителя, 2 мл буферного раствора и экстрагировали 5 мл хлороформа. После отделения экстракта оптическую плотность измеряли на фотоэлектроколориметре ФЭК-М.
Для экстракции пахикариина гидройодида пригоден любой из изученных красителей.
Большинство экстрактов пахикарпина гидройодида имело желтый цвет, однако с некоторыми красителями он изменялся в зависимости от величины pH. Изучены спектры поглощения экстрактов, содержащих соединения пахикарпина гидройодида с бромфеноловым синим, бромхлорфеноловым синим, бромкрезоловым зеленым. Растворителями при экстракции соединений пахикарпина с красителями служили хлороформ, дихлорэтан и бензол. Спектры снимали на спектрофотометре СФ-10. Оказалось, что бензольные экстракты пахикарпина гидройодида с изучаемыми красителями имеют желтый цвет (максимум поглощения 420 ммк). Цвет хлороформных и дихлорэтановых эсткрактов с этими же красителями изменяется в зависимости от pH среды. На рис. 1 приведены спектры поглощения хлороформных экстрактов в соединении с бромфеноловым синим при pH от 1, 0 до 9, 0; при pH 1, 0—4, 0 максимум абсорбции находится при длине волны 420 ммк, начиная с pH 6 этот максимум уменьшается и появляется другой при длине волны 610 ммк, который возрастает при дальнейшем увеличении pH. При pH 9,0 максимум поглощения остается только при длине волны 610 ммк. Соли таких алкалоидов, как стрихнин нитрат, атропин сульфат, димедрол гидрохлорид, тропацин, папаверин гидрохлорид, сальсолин гидрохлорид, кодеин-основание, кодеин-фосфат, платифиллин гидротартрат, аминазин, морфин гидрохлорид, пилокарпин, дионин, дибазол, кокаин в соединении с бромфеноловым синим при pH 9, 0, не экстрагируются хлороформом или имеют максимум абсорбции при других длинах волн. Это мы использовали для избирательного определения пахикарпина гидройодида в присутствии указанных алкалоидов.
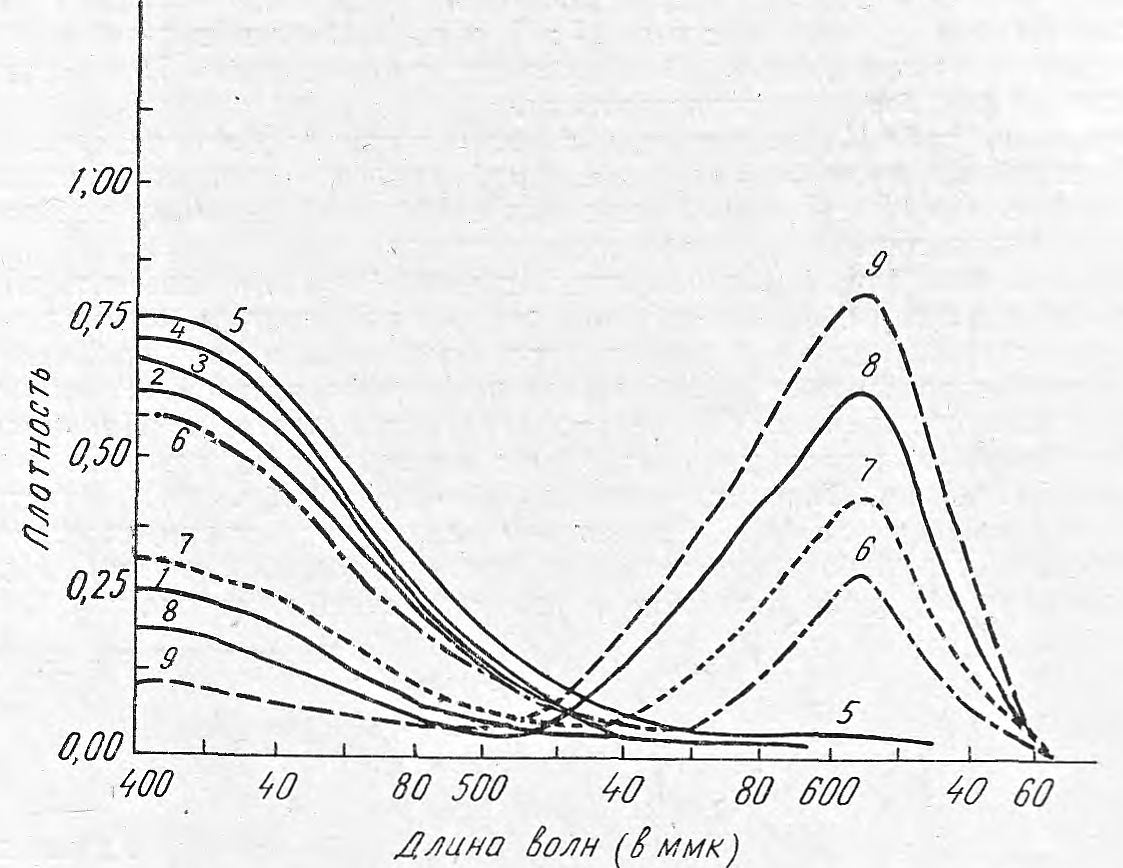
Рис. 1. Спектры поглощения хлороформных экстрактов с бромфеноловым синим.
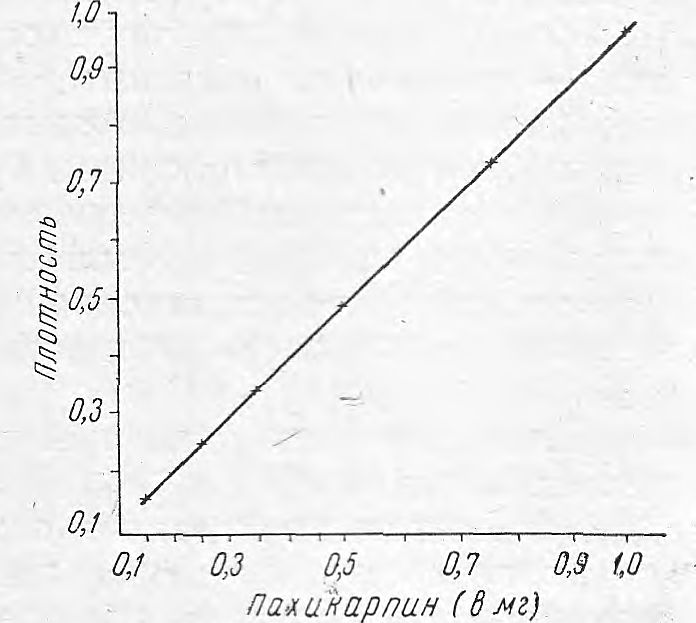
Рис. 2. Влияние, избытка красителя на экстракцию.
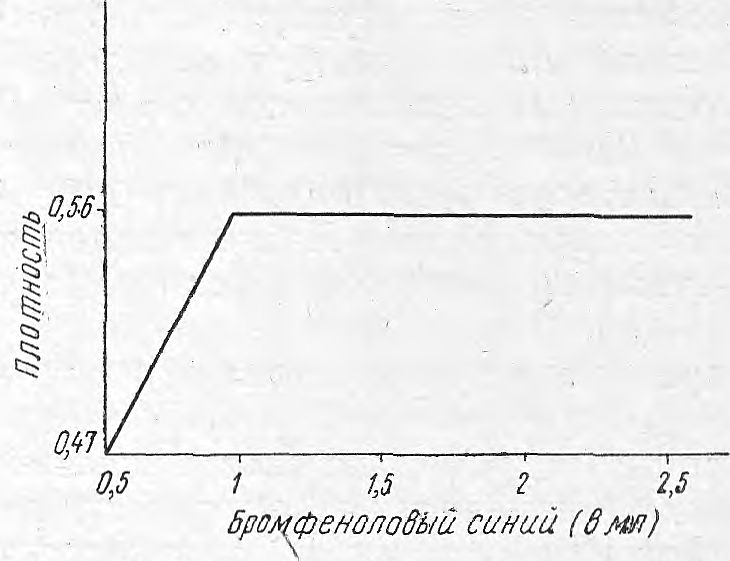
Рис. 3. Калибровочная кривая.
Для выяснения необходимой концентрации бромфенолового синего при экстракции соединения его с пахикарпином гидройодидом хлороформом проделали серию опытов. К 1 мл раствора пахикарпина гидройодида, содержащего 0,5 мг/мл вещества, добавляли различные количества 0,5% раствора красителя бромфенолового синего, 2 мл фосфатного буферного раствора (pH 9,0), экстрагировали алкалоид 2 порциями хлороформа по 5 мл, которые сливали вместе, доводили до 10 мл чистым хлороформом и измеряли плотность экстрактов на фотоэлектроколориметре ФЭК-М с зеленым светофильтром в 10 мм кювете. Результаты приведены на рис. 2, где видно, что избыток красителя не влияет на плотность экстрактов, содержащих соединения пахикарпина с бромфеноловым синим. В дальнейшем брали 2 мл 0,5% раствора красителя бромфенолового синего на 1 мл раствора пахикарпина гидройодида (0,1—1 мг/мл).
На основании полученных данных мы разработали методику количественного определения пахикарпина гидройодида в судебно-химическом анализе.
Для построения калибровочной кривой использовали пахикарпин гидройодид, отвечающий требованиям ГФIХ. Готовили раствор, содержащий 0,5 мг/мл пахикарпина гидройодида. Затем соответственно к 0,1; 0,3; 0,5; 1,0; 1,5; 2 мл раствора добавляли по 2 мл фосфатного буферного раствора pH 9, 0 и экстрагировали алкалоид 4 порциями хлороформа по 2, 5 мл. Экстракты объединяли и измеряли оптическую плотность на фотоэлектроколориметре ФЭК-М с зеленым светофильтром в кювете 10 мм. Калибровочная кривая представлена на рис. 3, где видно, что светопоглощение окрашенных растворов соединения пахикарпина с бромфеноловым синим в хлороформе подчиняется закону Бугера—Ламберта—Бера в интервале концентраций от 0,15 до 1 мг этого алкалоида в пробе.
Пахикарпин гидройодид из биологических объектов выделяли методом Крамаренко. Брали пробы по 10 г измельченного трупного материала, в каждую из них соответственно добавляли различные количества пахикарпина гидройодида: 0,15; 0,25; 0,35; 0,5; 1 мг. Параллельно проводили опыты с трупным материалом, не содержащим пахикарпин гидройодид. Все пробы заливали слабым водным раствором серной кислоты до покрытия жидкостью твердых частиц, добавляли серную кислоту до pH 2, 5, смесь оставляли на 2 часа, после чего процеживали через марлю. Твердые остатки еще раз настаивали 2 часа с водой, подкисленной серной кислотой (pH 2,5). Процеженные жидкости, полученные при каждом настаивании, соединяли и центрифугировали. Надосадочную жидкость сливали, осадок обрабатывали водным раствором серной кислоты (pH 2,5) и центрифугировали. К объединенным вытяжкам добавляли сульфат аммония до насыщения. Если при этом pH изменялся, его доводили до 2,5. Осадок с примесями отделяли центрифугированием. Для отделения примесей экстрагировали дважды 5 мл эфира. Эфирный слой отделяли, а к кислой водной вытяжке добавляли 2 н. раствора едкого натра до pH 8, 5—9, 0. Из подщелоченной вытяжки пахикарпин 4 раза экстрагировали хлороформом по 5 мл, извлечения соединяли и упаривали на водяной бане до объема 10 мл. Добавляли 2 мл фосфатного буферного раствора (pH 9,0), 2 мл 0,5% раствора красителя бромфенолового синего. После отделения экстракта измеряли оптическую плотность на фотоэлектроколориметре ФЭК-М с зеленым светофильтром в 10 мм кювете. Полученные результаты откладывали на калибровочной кривой (см. рис. 3) и находили количество пахикарпина гидройодида в определяемой пробе. Результаты анализа и статистическая обработка их приведены в табл. 1.
Контрольный опыт показал, что бромфеноловый синий при pH 9, 0 не взаимодействует с остатками, выделенными из биологического материала, не содержащего пахикарпин гидройодид.
Для доказательства возможности применения предлагаемой методики в судебно-химическом анализе поставлены опыты на кроликах. Одному кролику через рот вводили смертельную дозу пахикарпина гидройодида — 500 мг -на 1 кг веса тела — и определяли количество пахикарпина гидройодида во внутренних органах. Другому кролику через рот вводили 100 мг водного раствора пахикарпина на 1 кг веса тела и через 30 мин. брали 1 мл крови и собирали мочу. Через 1,5 часа кролика забивали и определяли пахикарпин в органах (табл. 2).
Таблица 1
Количественное определение пахикарпина в биологическом материале
Взято пахикарпина (в мг) | Оптическая плотность | Найдено |
Относительная ошибка | Средняя относительная ошибка | |
в мг | В % | ||||
0,15 | 0,17 | 0,15 | 100 | 0 | 2,05 |
0,25 | 0,26 | 0,24 | 96 | 4 | |
0,35 | 0,36 | 0,34 | 97,01 | 2,99 | |
0,50 | 0,50 | 0,49 | 98 | 2 | |
0,75 | 0,75 | 0,74 | 98,66 | 1,34 | |
1,0 | 0,98 | 0,98 | 99 | 2 | |
Таблица 2
Определение пахикарпина гидройодида в органах кроликов
| Объект исследования | Выделено пахикарпина (в мг%) | |
| кролик №1 | кролик №2 | |
| Желудок | 84 | 9,4 |
| Кровь | 44 | 1 |
| Почка | 10,4 | 7 |
| Сердце | 0,09 | 0,07 |
| Печень | 3,4 | 3,6 |
| Моча | 20 | |
Как видно из табл. 2, при введения внутрь небольших количеств алкалоида он количественно определяется во всех органах. Кроме того, из опыта с кроликом № 2 можно сделать заключение, что пахикарпин количественно определяется не только на трупном материале, но и в том случае, если живой организм получил не смертельную дозу, а токсическую. В этом случае лучше исследовать мочу и кровь.
Выводы
- Изучена экстрагируемость соединений пахикарпина гидройодида с красителями: бромфеноловым синим, бромтимоловым синим, бромкрезоловым зеленым, бромхлорфеноловым синим, крезоловым красным, бромкрезоловым пурпурным, бензопурпурином и метилоранжем.
- Исследованы спектры поглощения соединений с бромфеноловым синим, бромхлорфеноловым синим и бромкрезоловым зеленым. Спектры поглощения хлороформных экстрактов с бромфеноловым синим при pH 9, 0 имеют 2 максимума абсорбции (420 и 610 ммк).
- Изучена возможность определения в смеси с сульфатом атропина, аминазином, гидрохлоридом папаверина, тропацином, гидрохлоридом сальсолина, гидрохлоридом сальсолидина, дионином, дибазолом, гидрохлоридом морфина, гидротартратом платифиллина, кокаином и пилокарпином.
- Разработана методика -определения в биологических объектах экстракционно-спектрофотометрическим методом, основанная на экстракции с бромфеноловым синим при pH 9,0.
- Разработана методика определения в органах -отравленного животного.
похожие статьи
Перспективы использования параметров окислительной модификафии белков сыворотки крови для установления длительности агонального периода / Эделев И.С., Обухова Л.М., Андриянова Н.А., Эделев Н.С. // Судебная медицина. — 2019. — №3. — С. 28-32.
Обнаружение рокурония в биологических объектах методом высокоэффективной жидкостной хроматографии/масс-спектрометрии / Матвеева А.А., Федорова К.В., Лопушанская Е.М., Киреева А.В. // Судебная медицина. — 2019. — №2. — С. 49-51.
Изучение распределения неостигмина метилсульфата в организме теплокровных животных после внутрижелудочного введения / Алехина М.И., Шорманов В.К., Никитина Т.Н., Маркелова А.М. // Судебно-медицинская экспертиза. — М., 2019. — №2. — С. 40-47.
Обнаружение 25B-NBOMe — производного фенилэтиламина в биологическом материале / Барсегян С.С., Кирюшин А.Н., Ерощенко Н.Н., Туаева Н.О., Носырев А.Е., Кирилюк А.А. // Судебно-медицинская экспертиза. — М., 2019. — №2. — С. 34-39.
Особенности распределения 2,4- и 2,6-ди-трет-бутилгидроксибензола в организме теплокровных животных / Шорманов В.К., Цацуа Е.П., Асташкина А.П. // Судебно-медицинская экспертиза. — М., 2019. — №1. — С. 36-42.