К вопросу посмертного хемотаксиса лейкоцитов
/ Бихерт Е.А., Демчук О.Н., Власюк И.В. // Избранные вопросы судебно-медицинской экспертизы. — Хабаровск, 2018 — №17. — С. 47-50.

Е.А. Бихерт1, О.Н. Демчук2, И.В. Власюк1
1Кафедра патологической анатомии и судебной медицины (зав. – д.м.н., проф. А.И. Авдеев) ФГБОУ ВО ДВГМУ Минздрава России, г. Хабаровск
2КГБУЗ «Бюро судебно-медицинской экспертизы» министерства здравоохранения Хабаровского края (нач. – к.м.н. А.В. Нестеров), г. Хабаровск
Хемотаксис – процесс активного движения лейкоцитов к химическим раздражителям. Различают хемотаксис положительный (движение к объекту фагоцитоза) и отрицательный (движение фагоцита от объекта фагоцитоза) [2].
Процессу эмиграции лейкоцитов предшествует нарушение осевого тока движения крови внутри сосуда. В условиях замедления кровотока эритроциты, объединяясь в «монетные столбики», занимают центральную часть сосуда, а лейкоциты, имеющие более низкую удельную массу, выходят из осевого тока сначала на границу плазматического слоя, а затем начинают прилипать к эндотелиальным клеткам сосуда.
Взаимодействие молекул адгезии лейкоцитов и активированных клеток эндотелия служит основой процесса эмиграции лейкоцитов из кровяного русла. Процесс осуществляется в 4 стадии.
Стадия 1 (стадия качения) – лейкоциты взаимодействуют с клетками сосудистой стенки непрочно, и клетки перекатываются вдоль стенки капилляра или венулы по направлению тока крови. Эта фаза занимает 1–5 с.
Стадия 2 (стадия активации). Хемокины, продуцируемые эндотелиальными клетками, воздействуют на рецепторы лейкоцитов и вызывают их активацию с участием ГТФ-связывающих белков. Одновременно с этим происходит слабое взаимодействие лейкоцитарных интегринов с их рецепторами, экспрессированными под влиянием цитокинов на поверхности эндотелиальных клеток. Эта стадия занимает до 20 с.
Стадия 3 (стадия прочной адгезии) – взаимодействие лейкоцитарных интегринов с рецепторами эндотелиальных клеток становится прочным, и клетки останавливаются.
Стадия 4 (стадия экстравазации). После остановки лейкоцит становится доступным для хемотаксических сигналов, поставляемых хемокинами и другими хемотаксическими факторами. В продвижении между эндотелиальными клетками решающая роль принадлежит гомотипическим (подобное с подобным) взаимодействиям 2 типов, осуществляемых молекулами РеСАМ (СБ31) и СБ99. Экстравазация лейкоцита занимает до 10 мин [5].
Дальнейшее продвижение лейкоцитов осуществляется за счет адгезивных взаимодействий с межклеточным матриксом и хемотаксического вектора, задаваемого гуморальными факторами, исходящими из очага воспаления. Обязательное условие направленного движения клеток – градиент хемотаксических факторов. Показано, что перепад концентрации фактора должен составлять не менее 1 % на дистанцию, равную диаметру клетки.
В большинстве случаев острого воспаления внутрисосудистые перемещения лейкоцитов и их эмиграция занимают несколько часов. Как правило, первыми в очаг воспаления выходят нейтрофилы, они обнаруживаются в воспаленной ткани уже через 6–24 часа. Несколько позднее эмигрируют моноциты и лимфоциты (24–48 часов). Однако скорость хемотаксического перемещения нейтрофилов и моноцитов сопоставима (около 15 мкм/мин, т.е. почти 1 мм/ч). Такая асинхронность эмиграции клеток обусловлена неодновременным появлением молекул адгезии и хемотаксических факторов, специфичных для разных лейкоцитов, а также с разной исходной локализацией: нейтрофилы преобладают в пристеночном слое сосудистого русла и быстрее начинают движение к очагу воспаления.
Нужно отметить, что временные интервалы эмиграции лейкоцитов и последовательность их выхода весьма относительны и определяются типом сосуда, видом и стадией воспаления [4].
Исходя из вышеизложенного механизма хемотаксиса можно сделать вывод, что для его осуществления необходимо включение всех механизмов воспалительной реакции, в том числе нейрогуморальной регуляции, то есть необходима согласованная работа нервной и гуморальной систем. Учитывая, что у ЦНС наиболее короткий период приживаемости – до 5–6 мин с максимумом до 30 мин, воспалительные процессы, в том числе хемотаксис лейкоцитов, после смерти маловероятны.
Нами было исследовано несколько статей, посвященных изучению повреждений, нанесенных посмертно. В частности, в статье Исакова с соавторами «К судебно-медицинской оценке кровоизлияний» [3] проводилось изучение кровоизлияний, нанесённых после смерти. По результатам исследования были сделаны выводы о том, что причинами посмертного возникновения кровоизлияний являются разрушенные кровеносные сосуды с последующим выходом крови (под воздействием силы тяжести) в окружающие ткани с их пропитыванием и образованием свертков. Однако, исходя из данных указанной статьи, посмертно причиненные повреждения в виде кровоизлияний по своим макроморфологическим и гистологическим признакам могут быть весьма сходными с прижизненными и привести к экспертным ошибкам. В данном случае следует учитывать, что кровь, выходящая из кровеносных сосудов, содержит, помимо эритроцитов, клетки белой крови, из-за чего при недостаточно внимательном исследовании возможна ошибочная интерпретация этих клеток как клеток воспалительного ряда.
Данная проблема была также освещена в статье Берга О.Ю. с соавторами «К вопросу о прижизненности и давности причинения повреждений при механической травме» [1], где изучалась динамика морфологических изменений тканей в зоне постмортальных повреждений, нанесенных дозированно тупым твердым предметом спустя 4–6 часов после биологической смерти: через несколько минут после причинения повреждений в этой области образовывались четко выраженные синюшного цвета кровоподтеки, на разрезах в подкожной клетчатке и поверхностных мышцах, в проекции ударного воздействия были выявлены темно-красные очаговые кровоизлияния. Далее проводилось изучение гистологических срезов мягких тканей на границе с неповрежденными тканями с определенными интервалами времени. По результатам исследований были сделаны выводы о том, что морфологические изменения в зоне посмертно нанесенных повреждений по своим морфологическим показателям были схожи с прижизненно причиненными.
Данные статьи навели нас на мысль о возможности существования такого явления, как посмертный хемотаксис лейкоцитов.
Учитывая, что срок жизни зрелых лейкоцитов в кровяном русле составляет около 8–12 часов, не имеет смысла исследование данного процесса в более поздние сроки, поскольку после этого промежутка времени хемотаксис заведомо происходить не будет. Кроме того, в этот временной промежуток может формироваться морфологическая картина, характерная для переживаемости тканей, что сопровождается тем, что в зоне повреждения в постмортальном периоде возникают морфологические изменения, схожие с изменениями, возникающими в зоне прижизненно причинённых повреждений.
Для изучения данного процесса нами были исследованы микропрепараты, изготовленные из мягких тканей лиц, погибших в результате транспортных происшествий с участием автомобилей, поездов, падения с высоты, травмы, нанесенной тупыми и острыми предметами, огнестрельных ранений, а также в результате ожогов, при которых смерть наступила на месте происшествия мгновенно. Вскрытие проводилось через 12–18 часов после смерти, что позволяло в полной мере оценить возможную посмертную реакцию на повреждения.
В представленных гистологических препаратах определяются кровоизлияния, представленные эритроцитами с четкими контурами, среди которых не определяются лейкоциты. Перифокально сосуды малокровны, спазмированы. В сосудах и окружающих тканях клетки воспалительного ряда не определяются (рис. 1).
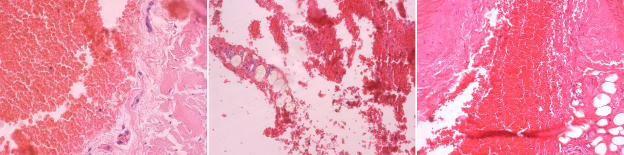
Рис.1. Кровоизлияния, представленные эритроцитами с четкими контурами, среди которых не определяются лейкоциты
Таким образом, по результатам исследования микропрепаратов нам не удалось выявить существование процесса посмертного хемотаксиса лейкоцитов.
Список литературы
- Берг О.Ю. К вопросу о прижизненности и давности причинения повреждений при механической травме / Берг О.Ю., Пикулева М.В., Исаев Ю.С. // Актуальные вопросы судебной и клинической медицины. – Ханты-Мансийск, 2008. – В. 10. – С. 17–18.
Березнякова А.И. Патологическая физиология: учебник. – Х.: Изд- во НФАУ, 2000. – 448 с.
- Исаков В.Д. К судебно-медицинской оценке кровоизлияний / В.Д. Исаков, Г.П. Лаврентюк, В.Е. Сысоев, М.Т. Исмаилов // Судебно-медицинская экспертиза. – 2009. – № 3. – С. 3–5.
- Свободнорадикальные процессы и воспаление (патогенетические, клинические и терапевтические аспекты): учеб. пособие / Сологуб Т.В., Романцова М.Г., Кремень Н.В и др. – Академия естествознания, 2008.
- Ярилин А.А. Иммунология / А.А. Ярилин. – М.: ГЭОТАР-Медиа, 2010. – 752 с.
похожие статьи
Редкий случай травмы шеи при извлечении тела из воды / Виндгассен М., Ресслер Л., Тсокос М., Эстерхельвег Л. // Судебная медицина. — 2019. — №4. — С. 32-33.
Роль иммуногистохимического исследования в установлении прижизненности и выраженности огнестрельных повреждений мягких тканей / Богомолов Д.В., Федулова М.В., Шай А.Н., Павлова А.З., Збруева Ю.В. // Судебно-медицинская экспертиза. — М., 2018. — №6. — С. 46-47.
Морфологическая характеристика коры мозжечка при ожоговой травме / Морозов Ю.Е., Дорошева Ж.В., Горностаев Д.В., Колударова Е.М., Пиголкин Ю.И. // Судебно-медицинская экспертиза. — М., 2018. — №4. — С. 24-27.
Установление прижизненности механической травмы по биохимическим показателям / Асташкина О.Г., Столярова Е.П., Полтарев С.В., Терешина Н.А. // Медицинская экспертиза и право. — 2010. — №3. — С. 43-45.
Использование метода контактной микрорентгенографии для дифференциальной диагностики прижизненных и посмертных повреждений надкостницы / Чистова Т.И. // Матер. IV Всеросс. съезда судебных медиков: тезисы докладов. — Владимир, 1996. — №2. — С. 45-46.