Частный метод обнаружения и определения хрома в биологическом материале
/ Яблочкин В.Д. // Судебно-медицинская экспертиза. — М., 1963 — №3. — С. 45-49.

Кафедра судебной химии (зав. — проф. М.Д. Швайкова) I Московского ордена Ленина медицинского института имени И.М. Сеченова
Поступила в редакцию 7/VI 1962 г.
Доказательство присутствия хрома в биологическом материале сопряжено с большими трудностями вследствие значительных потерь вещества при полном судебнохимическом анализе на различных этапах исследования.
Согласно данным А.Ф. Рубцова, по систематическому ходу анализа определяется всего от 30 до 60% хрома, добавленного к биологическому материалу в количестве 10 мг, граница же обнаружения элемента после минерализации биологического материала серной и азотной кислотами находится в пределах 0, 5 мг, или 500 у.
За последнее десятилетие перспективным направлением в отечественной судебной химии была разработка дробных и частных методов обнаружения и определения соединений тяжелых металлов. Для хрома подобного метода пока нет. Трудности разработки метода определения хрома в присутствии других катионов связаны с поливалентной природой элемента,, его способностью образовывать прочные заряженные анионные и катионные комплексы [Л.М. Вольштейн, Густавсон (Gustavson)] и нейтральные комплексные соединения, что создает ряд затруднений и делает малоэффективным применение ионнообменных смол для выделения хрома из минерализата или отделения от него мешающих дальнейшему анализу ионов (например, Fe2+ и Fe3+).
Более перспективны для решения этой задачи экстракционные методы, позволяющие достаточно полно отделить мешающие вещества. В настоящее время мы не располагаем селективным экстракционным методом для выделения хрома из минерализата. Экстрагирование в виде надхромовой кислоты, дающее удовлетворительные результаты на «чистых» растворах, мало пригодно для извлечения хрома из минерализата, содержащего большие количества железа, которое энергично разлагает перекисные соединения, особенно в щелочной среде.
При разработке частного метода обнаружения и определения хрома в биологическом материале мы взяли за основу специфичный для этого элемента колориметрический метод его определения в виде трило- натного комплекса (Ю.И. Усатенко, Е.А. Климкович). Концентрации хрома 0,5—80 γ/мл подчиняются закону Бера. Определению мешают собственной окраской Си2 +, Со2+ и Ni3+ (Ю.Ю. Лурье), а также железо, образующее с трилоном Б соединение красного цвета. Медь, кобальт и никель удается отделить от хрома количественно, использовав свойство пиридина избирательно осаждать гидроокиси некоторых тяжелых металлов при pH 6 (Э.А. Остроумов). При этом перечисленные выше мешающие катионы образуют с органическим основанием растворимые комплексные соединения, которые можно легко и полно десорбировать из осадка гидроокисей промыванием последнего слабым раствором электролита. Одновременно с хромом в виде гидроокиси осаждается железо, которое затем в виде хлорида может быть отделено путем экстрагирования эфиром из солянокислого раствора.
Разработанный нами метод позволил значительно сократить потери хрома, имеющиеся при сероводородном способе его отделения от других веществ. Озоление биологического материала смесью серной, азотной и хлорной кислот дало возможность также уменьшить потери хрома за счет соосаждения его с осадком сульфатов кальция, бария и свинца.
Экспериментальная часть
1 Изолирование хрома из биологического материала
Биологический материал озоляли в колбах Кьельдаля и аппаратах Бетге смесью серной, азотной и хлорной кислот по Каану, для чего к 100 г печени трупа человека, деструктированной смесью серной и азотной кислот (25 мл концентрированной серной+50 мл концентрированной азотной), добавляли 30 мл 57% HClO4.
Каан предлагает добавлять 15—60 мл хлорной кислоты. Проведенное нами ранее изучение характера изменения уровня окислительных потенциалов показало, что если количество хлорной кислоты, взятой для озоления, не превышает 15 мл, то понижение окислительного потенциала наступает задолго до завершения минерализации; это свидетельствует о недостатке окислителя. Конец озоления в этих условиях сопровождается соосаждением хрома с осадком сульфатов щелочноземельных металлов. Избыток хлорной кислоты также приводит на последнем этапе стадии глубокого окисления к потерям хрома в виде хлористого хромила. Для объекта средней жирности оптимальный объем 57% HClO4 находится в пределах 30—35 мл.
Озоление необходимо завершать с наступлением изменения окраски минерализата из зеленой в желтую (окисление Cr3+ до Cr6+), нагревая полученный минерализат еще не более 1—2 минут, так как более длительный нагрев сопряжен с потерями до 15% хрома за счет образования хлористого хромила и восстановлением хрома перекисью водорода (Н.В. Белоградская, В.И. Петрашень, В.З. Рудой), образующейся за счет термического распада кислот (Э.И. Креч).
2. Методика частного метода выделения хрома из минерализата
а) Отделение хрома от мешающих веществ. Для количественного определения берут весь минерализат или 1/2 его часть в зависимости от содержания хрома. Если минерализат до завершения полного окисления органических веществ имел лишь очень слабую зеленоватую окраску, то в озоляемой навеске биологического материала проводят только качественное обнаружение искомого ядовитого вещества. Мы использовали 1/2 часть минерализата, разбавленного до 100 мл.
В полученный раствор добавляли 0,2 г безводного сульфита натрия, нагревали до кипения, охлаждали, нейтрализовали избыток кислоты 40% раствором едкой щелочи до pH 6 (по универсальному индикатору), добавляли 20 мл 25% раствора пиридина.
Раствор слабо нагревали, избегая закипания, для коагуляции образовавшегося осадка и фильтровали через складчатый фильтр. Осадок на фильтре тщательно промывали горячим 1 % раствором хлорида аммония и растворяли в 20—25 мл HCl (d—1,19), к которой предварительно добавляли кристаллик КСlO3 . Фильтр прокалывали пастеровской пипеткой и промывали 10—20 мл дистиллированной воды. Объединенный с промывными водами солянокислый раствор упаривали в фарфоровой чашке объемом 50 мл до «мокрых» солей (образование влажного остатка солей). Влажный остаток смешивали с 3 мл HCl (d—1,19), насыщенной при охлаждении эфиром до разделения фаз, и с 2—5 каплями дистиллированной воды. Сначала экстрагировали 2 порциями эфира по 15 мл каждая непосредственно в выпарительной чашке, пользуясь стеклянной палочкой. По удалении декантацией слоя органического растворителя солянокислый раствор разбавляли водой до полного растворения солей, смешивали с равным объемом HCl (d—1,19), и вновь дважды экстрагировали уже в делительной воронке, вводя каждый раз по 10 мл эфира.
После двукратной экстракции солянокислый слой переносили из делительной воронки в мерную колбу, доводя объем до 50 мл.
б) Качественное обнаружение хрома. Для проверочных качественных реакций использовали 10 мл аликвотной части. Для окисления Cr3+ до Cr6+ исследуемый раствор нагревали с 3 мл концентрированной серной кислоты в колбе Кьельдаля объемом 50 мл до появления белых паров, охлаждали до 100—120°, смешивали с 5 мл 57% хлорной кислоты и вновь нагревали до появления белых паров. Полученный раствор разбавляли до 10 мл. К 5 мл исследуемого раствора добавляли 1 мл 0,4% раствора дифениламина в серной кислоте. При этом наблюдалось синее окрашивание. Хлорная кислота не мешает проведению реакции. Открываемый минимум 0,25 -у/мл хрома. Предельное разбавление равно 200 000 (Ф.М. Шемякин с сотрудниками).
Оставшиеся 5 мл исследуемого раствора нейтрализовали 40% раствором едкой щелочи и смешивали с равным объемом 0,1 н. раствора нитрата серебра. Спустя некоторое время наблюдали желтый осадок состава Ag2 (SO4, CrO4). Открываемый минимум 0,0035 Cr6+. Предельная концентрация 1:570 000 (И.М. Коренман).
Таблица 1
Изучение частного метода определения хрома на «чистых» водных растворах
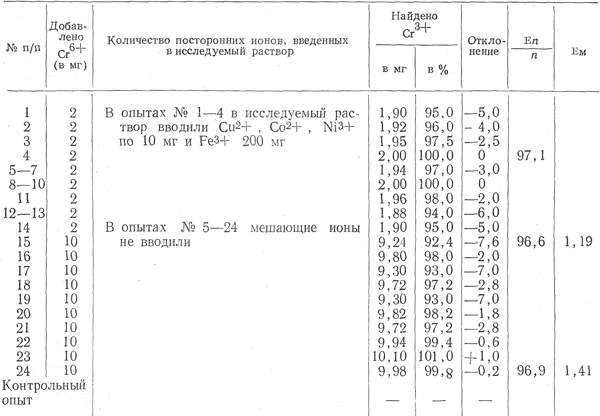
Примечание. Σ n/n — среднее арифметическое значение; Fм — среднее квадратическое отклонение одного определения.
в) Количественное определение хрома. Для количественного определения хрома использовали 40 мл исследуемого раствора. Раствор помещали в колбу Эрленмейера емкостью 250 мл, добавляли 25 мл 0,1 н. раствора трилона Б и 2—3 капли фенолфталеина, нагревали до кипения, слегка охлаждали и нейтрализовали 25% раствором аммиака до появления красно-фиолетовой окраски, после чего кипятили 3—5 минут, охлаждали и доводили в мерной колбе на 200 мл до метки ацетатным буферным раствором (pH 5). Параллельно готовили стандартную шкалу с содержанием хрома 5—80 у/мл. Окраску стандартного и испытуемого растворов сравнивали сначала визуально в колориметрических пробирках емкостью 20 мл, затем с помощью колориметра Дюбоска, используя желто-зеленый светофильтр (570 urn).
Разработанный нами метод выделения хрома из минерализата был сначала изучен на «чистых» водных растворах соли хрома, при этом учитывали влияние мешающих ионов на точность анализа. Результаты показаны в табл. 1, из которой видно, что разработанный нами метод позволяет практически полностью отделить Си 2 +, Со 2+ и №3+ , добавленные в количестве 10 мг, а также железо в количестве 200 мг, и определить 96—97% хрома, введенного в исследуемый раствор в количестве 2—10 мг.
Для изучения частного метода на биологическом материале к 100 г тщательно измельченной печени трупа человека за сутки до опыта при перемешивании добавляли определенный объем раствора бихромата калия. Обнаружение и определение хрома проводили после его выделения из минерализата по систематическому ходу анализа и частным методом. Результаты показаны в табл. 2.
Таблица 2
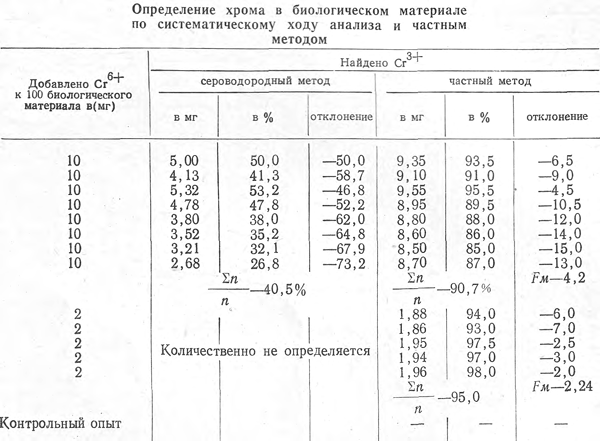
Примечание. Σ n/n — среднее арифметическое значение; Fм — среднее квадратическое отклонение одного определения.
После разрушения 100 г биологического материала серной, азотной и хлорной кислотами и выделения хрома из всего объема минерализата частным методом граница обнаружения элемента описанными выше реакциями с нитратом серебра и дифениламином составляла 50 у, в то время как по систематическому ходу анализа обнаруживалось не менее 250 у. Описанный метод позволяет сократить потери элемента более чем в 5 раз при значительно меньшей затрате времени.
Таблица 3
Определение хрома в органах трупа животного, затравленного бихроматом калия
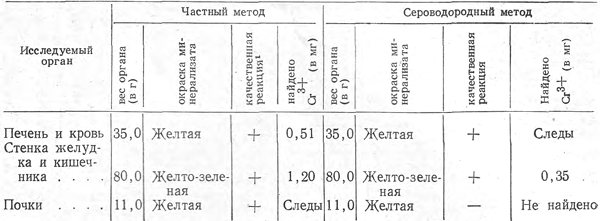
1 Качественно хром обнаруживали реакцией с раствором нитрата серебра.
Метод был проверен на органах затравленного животного. Кролику (самка) весом 2900 г вводили в пищевод с помощью катетера 0,1 г бихромата калия в 1% водном растворе. Органы животного гомогенизировали на электрическом измельчителе тканей. Равные части каждого органа, взятые для исследования, разрушали серной, азотной и хлорной кислотами. Хром отделяли от других катионов по систематическому ходу анализа и частным методом. Полученные данные представлены в табл. 3, из которой ясно преимущество частного метода перед сероводородным.
Выводы
- Разработаны условия выделения хрома из минерализата, полученного «мокрым» окислением биологического материала, с последующим его обнаружением и количественным определением.
- Потеря хрома после окисления биологического материала серной, азотной и хлорной кислотами и выделения его из минерализата частным методом составляет 2—15% при содержании 2—10 мг элемента в исследуемом объекте.
- Сравнительное изучение сероводородного и частного метода показало преимущества последнего как в отношении количества определяемого хрома, так и в отношении сокращения времени.
похожие статьи
Перспективы использования параметров окислительной модификафии белков сыворотки крови для установления длительности агонального периода / Эделев И.С., Обухова Л.М., Андриянова Н.А., Эделев Н.С. // Судебная медицина. — 2019. — №3. — С. 28-32.
Обнаружение рокурония в биологических объектах методом высокоэффективной жидкостной хроматографии/масс-спектрометрии / Матвеева А.А., Федорова К.В., Лопушанская Е.М., Киреева А.В. // Судебная медицина. — 2019. — №2. — С. 49-51.
Изучение распределения неостигмина метилсульфата в организме теплокровных животных после внутрижелудочного введения / Алехина М.И., Шорманов В.К., Никитина Т.Н., Маркелова А.М. // Судебно-медицинская экспертиза. — М., 2019. — №2. — С. 40-47.
Обнаружение 25B-NBOMe — производного фенилэтиламина в биологическом материале / Барсегян С.С., Кирюшин А.Н., Ерощенко Н.Н., Туаева Н.О., Носырев А.Е., Кирилюк А.А. // Судебно-медицинская экспертиза. — М., 2019. — №2. — С. 34-39.
Особенности распределения 2,4- и 2,6-ди-трет-бутилгидроксибензола в организме теплокровных животных / Шорманов В.К., Цацуа Е.П., Асташкина А.П. // Судебно-медицинская экспертиза. — М., 2019. — №1. — С. 36-42.