Постадийное изучение потерь гликозидов при судебно-химических исследованиях
/ Власенко Л.М. // Судебно-медицинская экспертиза. — М., 1978 — №4. — С. 35-38.

Научно-исследовательский институт судебной медицины (дир.— проф. В.И. Прозоровский) Министерства здравоохранения СССР, Москва
УДК 340.67:547.918
Постадийное изучение потерь гликозидов при судебно-химических исследованиях. Власенко Л.М. Суд.-мед. эксперт., 1978, № 4, с. 35-38./p>
Проведено постадийное изучение потерь дигитоксина, ланатозида С и строфанта на К при судебно-химических исследованиях трупного материала. Показано влияние прочности связи гликозидов с белками ткани печени на степень их изолирования.
Таблиц 3.
FOOTSTONE STUDY OF GLYCOZIDE LOSSES IN FORENSIC CHEMICAL ANALYSIS
L. M. Vlasenko
An experimental study regarding losses of digitoxine, S-lanatozide and K-strophan-tine in various stages of analysis of cadaveric matter. The grade of isolation depending on the connection solidity of the glycozides with hepatic albumin is demonstrated.
Проведенные нами исследования показали, что сердечные гликозиды в разной степени изолируются из тканей внутренних органов. Возврат добавленных в количестве 1 мг к 100 г свежей ткани печени гликозидов в среднем был следующим: ланатозида С — 74,9%, дигоксина — 69,9%, дигитоксина — 54,4%, строфантина К — 57,1%, строфантина Г — 47,0%. Для характеристики потерь представляло интерес постадийное их изучение при судебно-химическом исследовании на различные гликозиды, что и явилось целью настоящей работы.
Были избраны ланатозид С и дигитоксин как гликозиды одной и той же подгруппы дигиталиса, которые изолируются и очищаются по одной методике, но характеризуются наивысшей и наименьшей величинами выхода. Исследовали также строфантин К как представитель подгруппы строфанта, требующей принципиально иного способа очистки от экстрактивных веществ.


Примечание. При добавлении ланатозида С и строфантина К к ткани печени или к ее спиртовому гомогенату мы не получили статистически достоверной разницы в результатах их выхода. Поэтому для данных гликозидов стадию II самостоятельно не обрабатывали.
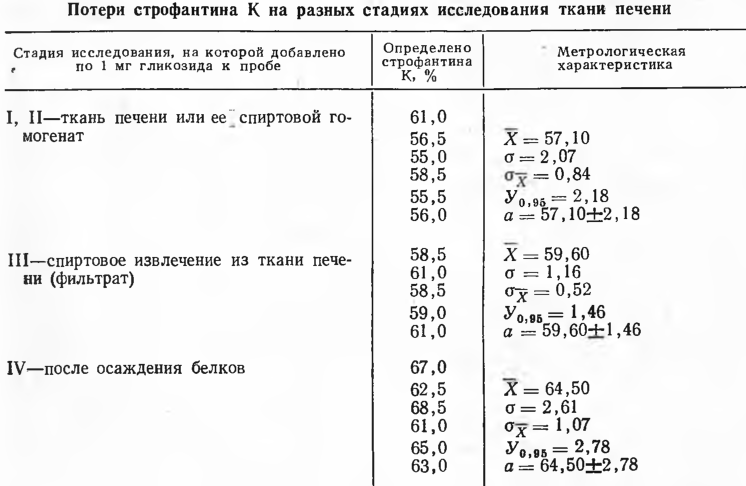
Опыты проводили с тканью печени трупов лиц, погибших от травмы. Гликозиды из расчета 1 мг на 100 г измельченного органа (средняя проба) добавляли на 4 разных стадиях: I — непосредственно к измельченной печени (до начала исследования), II —-к спиртовому гомогенату печени (к навеске, залитой спиртом), III — к спиртовому извлечению из печени (к фильтрату), IV — к спиртовой жидкости после осаждения и удаления белковой фракции экстрактивных веществ. Исследование выполняли ранее описанными методами (JI. М. Власенко, 1972, 1973, 1975). Однако колоночный адсорбционный метод очистки строфантина К от экстрактивных веществ заменили не менее эффективным, но более простым способом осаждения основным ацетатом свинца. Для этой цели модифицировали методику, предложенную для очистки извлечений гликозидов из растительных объектов (М.Г. Тарасова, 1962). В качестве осадителя использовали официнальный препарат основного ацетата свинца, описанный в ГФ VIII.
Таблица 3
Методика очистки. Выпаренные спиртово-хлороформные экстракты обрабатывали 10 мл 20% раствора этанола, количественно переносили в центрифужную пробирку емкостью 12—15 мл, подщелачивали 1 каплей 10% раствора едкого натра, прибавляли 8 капель раствора основного ацетата свинца, тщательно смешивали и оставляли на 3—5 мин. Затем прибавляли 0,2 мл 10% раствора сульфата аммония, перемешивали и вновь оставляли на 10 мин, после чего центрифугировали. Центрифугат сливали в делительную воронку, а чашку, пробирку и осадок промывали (2 раза по 5 мл) 20% раствором этанола. Промывную жидкость присоединяли к основному центрифугату, насыщали кристаллическим сульфатом аммония (как правило, достаточно 10,5 г) и 4 раза извлекали смесью хлороформа со спиртом 8:2 (10, 10, 5 и 5 мл). Извлечения фильтровали через слой безводного сульфата натрия и испаряли досуха при температуре не выше 60°С. В остатке определяли строфантин К по ранее описанной методике (Л.М. Власенко, 1975).
Полученные результаты (табл. 1—3) показали следующее.
1. В процессе изолирования дигитоксина, ланатозида С и строфантина К из ткани печени и осаждения белковой фракции экстрактивных веществ спиртом в большей степени теряется дигитоксин. Из общих потерь дигитоксина (45,6%) примерно 35% теряются при его изолировании и осаждении белков. Установлено, что основная масса этих потерь (примерно 28 из 35%) происходит на стадии осаждения спиртом и отделения белковой фракции экстрактивных веществ.
Совершенно иными были потери и их распределение при исследовании ланатозида С и строфантина К. Общие потери в процессе изолирования гликозида из ткани печени и осаждения белков спиртом составляли в среднем 6,1% Для ланатозида С и 7,4% для строфантина К, из этого количества на стадии осаждения белков терялось в среднем около 5% гликозида.
Это положение согласуется с признанными биохимическими данными о неодинаковой для разных гликозидов прочности связи с белками, например крови.
2. Степень изолирования органического вещества из биологического объекта нельзя характеризовать только его растворимостью в тех или иных растворителях: необходимо учитывать прочность его связи с белками и другими экстрактивными веществами. Так, дигитоксин и ланато зид С имеют примерно одинаковую растворимость в 95% этаноле (по нашим данным, в 100 мл его растворяется 1,30 г дигитоксина и 1,38 г ланатозида С), но при осаждении белков этанолом дигитоксин теряется на 28%, а ланатозид С — примерно на 5%.
3. Основные потери (в среднем 35%) строфантина К происходят в процессе его дополнительной очистки и экстракции и могут быть уменьшены с усовершенствованием этих операций.
Вывод
Изучены и обсуждены потери дигитоксина, ланатозида С и строфантина К на различных стадиях исследования трупного материала.
похожие статьи
Перспективы использования параметров окислительной модификафии белков сыворотки крови для установления длительности агонального периода / Эделев И.С., Обухова Л.М., Андриянова Н.А., Эделев Н.С. // Судебная медицина. — 2019. — №3. — С. 28-32.
Обнаружение рокурония в биологических объектах методом высокоэффективной жидкостной хроматографии/масс-спектрометрии / Матвеева А.А., Федорова К.В., Лопушанская Е.М., Киреева А.В. // Судебная медицина. — 2019. — №2. — С. 49-51.
Изучение распределения неостигмина метилсульфата в организме теплокровных животных после внутрижелудочного введения / Алехина М.И., Шорманов В.К., Никитина Т.Н., Маркелова А.М. // Судебно-медицинская экспертиза. — М., 2019. — №2. — С. 40-47.
Обнаружение 25B-NBOMe — производного фенилэтиламина в биологическом материале / Барсегян С.С., Кирюшин А.Н., Ерощенко Н.Н., Туаева Н.О., Носырев А.Е., Кирилюк А.А. // Судебно-медицинская экспертиза. — М., 2019. — №2. — С. 34-39.
Особенности распределения 2,4- и 2,6-ди-трет-бутилгидроксибензола в организме теплокровных животных / Шорманов В.К., Цацуа Е.П., Асташкина А.П. // Судебно-медицинская экспертиза. — М., 2019. — №1. — С. 36-42.