К вопросу об определении групп изосерологических систем Льюис и резус
/ Бронникова М.А., Багдасаров В.А., Барсегянц Л.О. // Судебно-медицинская экспертиза. — М., 1958 — №3. — С. 19-23.

Научно-исследовательский институт судебной медицины (дир. — проф. В. И. Прозоровский), Москва
Поступила в редакцию 19/IV 1958 г.
В серию исследований групповых факторов изосерологических систем, выходящих за пределы систем АВО и MNSs, было включено выяснение возможности обнаруживать в высохшей крови агглютиногены системы Льюис1, а также выявление в крови 5 агглютиногенов (С, с, D,. Е, е) системы резус.
Изосерологическая система Льюис
Мы располагали малым количеством стандартных сывороток анти-Leа и анти-Leb, причем эти сыворотки, особенно сыворотка ан-TH-Leb, не были высокого качества. Указанные обстоятельства в значительной мере ограничивали проведение экспериментов.
Из крови с предварительно установленной льюис-принадлежностью изготовлялись пятна на марле.
Таблица 1
Абсорбция агглютининов анти-льюис при различных температурных режимах

Обозначения: — отсутстви е агглютинации одноименных стандартных эритроцитов, т. е. полная абсорбция агглютинина; + хорошо выраженная агглютинация, т. е. отсутствие абсорбции агглютинина; + — несколько ослабленная агглютинация; — + еще более ослабленная агглютинация; (±) по зднее появление слабо выраженной агглютинации, обнаруженной при микроскопическом исследовании.
Поскольку обе сыворотки (анти-Leа и анти-Leb ) содержали полные антитела— агглютинины, осуществление реакции абсорбции не представляло особых затруднений. Можно было предвидеть лишь три осложнения: 1) недостаточное количество сывороток; 2) низкий их титр, что исключало возможность титрования исходных и абсорбированных сывороток при учете результатов реакции; 3) отсутствие каких бы то ни было данных об оптимальном температурном режиме и о длительности процесса абсорбции.
Прежде всего выяснялся вопрос, при какой температуре происходит наибольшее связывание агглютининов анти-Leb и анти-Lеъ. Сыворотка анти-Leа лучше всего агглютинировала одноименные эритроциты при температуре 22—24°, а сыворотка анти-Leb—при температуре 15°. Это послужило основанием для применения двух упомянутых температурных режимов и при реакции абсорбции агглютининов; кроме того, создавались обычные, принятые для обнаружения агглютининов других изосерологи- ческих систем, условия — пребывание смеси исследуемого материала и сывороток в рефрижераторе при температуре 4°.
К 50 мг измельченной марли с пятнами крови Le(a+b— ) и Le(a—Ь+ ) суточной давности и к контрольной марле (размер ее соответствовал площади пятен,крови) добавляли (отдельно) по 6 капель неразведенных сывороток анти-Leа и aнти-Leb. Абсорбцию проводили в течение 20—24 часов при температуре 22—24° для сыворотки анти-Le3, при температуре 16—17° для сыворотки aнти-Leb и при температуре 4° для обеих сывороток. К 2 каплям исходных и подвергшихся центрифугированию абсорбированных сывороток приливали по 2 капли 2% взвеси однократно отмытых соответствующих стандартных эритроцитов (группы 0). Ингридиенты смешивали путем легкого встряхивания пробирок. Смеси, в которых имелась сыворотка анти-Leа, оставляли на час, а смеси где была сыворотка анти-Leb, - при температуре 16°, после чего подвергали их центрифугированию в течение 1 минуты при 500 оборотов центрифуги. Пробирки слегка встряхивали; агглютинацию выявляли невооруженным глазом, при помощи лупы и под микроскопом.
Таблица 2
Определение агглютиногенов системы Льюис в пятнах крови
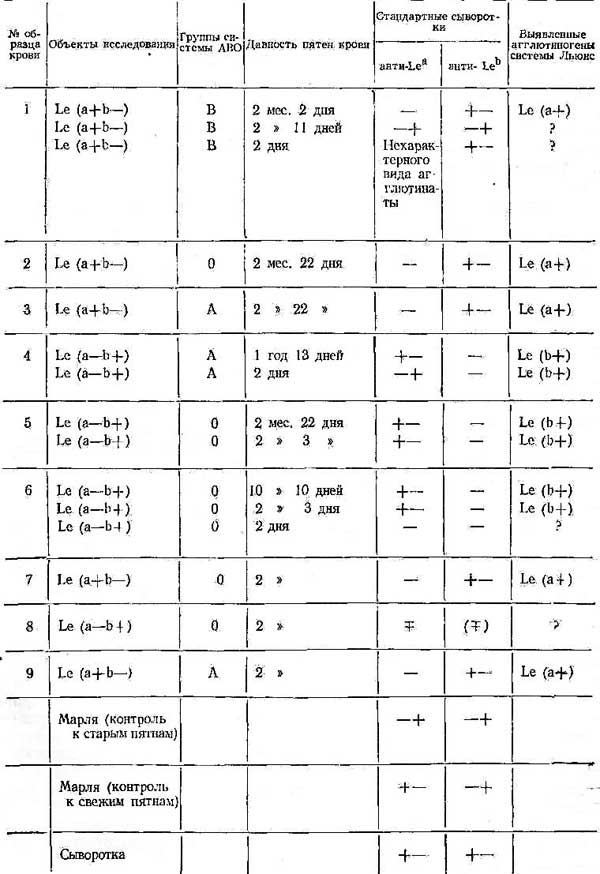
Агглютиногены Le(a+ ) и Le(b+) были обнаружены при всех температурных режимах процесса абсорбции, но стойкое полное связывание агглютининов анти-Leа и aнти-Leb имело место лишь после взаимодействия исследуемого материала и сывороток при температуре 4° (табл. 1).
Дальнейшие исследования проводились по вышеизложенной технике, причем абсорбция осуществлялась в рефрижераторе при температуре 4° (табл. 2).
В 11 случаях из 15 группы системы Льюис были определены. Следует отметить, что иногда неудачные результаты реакции абсорбции агглютининов анти-Leа и aнти-Leb (отсутствие полного связывания соответствующего агглютинина или неспецифическая абсорбция) относились к опытам с наиболее свежими пятнами крови, в то время как при исследовании старых пятен крови того же донора положительный исход реакции был вполне отчетливым.
Таким образом, определение групп системы Льюис в высохшей крови является возможным.
Агглютиногены Le(a+ ) и Le(b+) обладают достаточной устойчивостью, так как поддаются выявлению в следах крови, хранившихся длительный срок (до 1 года 13 дней в наших опытах).
Изосерологическая система Льюис может иметь значение для судеб- номедицинской экспертизы крови и заслуживает дальнейшего изучения.
Изосерологическая система резус
Прежде всего производилось исследование жидкой крови, взятой у доноров.
Стандартные сыворотки анти-С, анти-с, анти-D, анти-е содержали неполные антитела типа агглютиноидов и только в сыворотке анти-Е наряду с неполными имелись полные («солевые») антитела — агглютинины.
Применялась реакция конглютанации в двух вариантах.
1) Реакция в желатиновой среде по Фиск и Макги2 . В качестве желатиновой среды использовался биогель — раствор особо очищенного и забуференного желатина. Исследуемую кровь в цельном виде помещали в пробирки, на дне которых находилось небольшое количество порошкообразного оксалата (щавелевокислого натрия), что предотвращало свертывание крови. Реакцию проводили в обычных агглютинационных пробирках. К одной капле оксалатной крови добавляли одну каплю биогеля и одну каплю той или иной стандартной сыворотки. Смеси инкубировали в водяной бане при температуре 37° в течение 2 минут. Затем к каждой смеси приливали 1,5—2 мл физиологического раствора. Наличие или отсутствие конглютанации констатировали при рассматривании зоны смешивания ингредиентов невооруженным глазом и с помощью лупы. В случае отрицательного результата реакции содержимое пробирок переносили на предметные стекла и после распределения тонким слоем подвергали микроскопическому исследованию, причем иногда, при необходимости уточнить полученные данные, накрывали смеси покровными стеклами.
Конглютинация обычно была так хорошо выражена, что ее удавалось видеть не только при помощи лупы, но даже невооруженным глазом. Неспецифические явления и образование монетных столбиков не наблюдались.
2) Реакция в альбуминовой среде. Эту реакцию проводили следующим образом: одну каплю 2% взвеси дважды отмытых исследуемых эритроцитов в физиологическом растворе смешивали с одной каплей сыворотки анти-С, анти-с, анти-D, анти-Е или анти-е (в агглютинационных пробирках). Смеси инкубировали в термостате при температуре 37° в течение 1 1/2 часов, после чего отстоявшуюся жидкость осторожно отсасывали, не затрагивая осадка эритроцитов. К эритроцитам добавляли одну каплю раствора альбумина (не смешивая ингредиентов) и снова помещали пробирки на 30 минут в термостат, где поддерживалась температура 37°. Излишек жидкости удаляли, а осадок эритроцитов
переносили на предметные стекла, распределяя в виде тонкого слоя, и рассматривали под микроскопом.
Многочисленные исследования показали, что наиболее просто и быстро выполнимой является реакция конглютинации в желатиновой среде. Реакция в альбуминовой среде сложнее и требует большей затраты
времени.
Поскольку с судебномедицинской точки зрения особый интерес представляет обнаружение резус-антигенов в высохшей крови, были сделаны попытки выявить агглютиногены С, D и Е в пятнах крови на марле.
Предварительно разрешался вопрос о титровани и стандартных сывороток, содержащих неполные антитела.
В целях экономии стандартных сывороток различные методы титрования испытывались на двух сыворотках: анти-С и анти-D, что не имеет принципиального значения, так как в обеих сыворотках были неполные антитела одинакового типа (агглютиноиды).
Установлено, что метод исследования играет решающую роль в определении титра таких сывороток. Отсюда вытекает, что способ титрования обязательно должен быть стандартизован.
Вслед за титрованием сывороток анти-D и анти-С производилась реакция абсорбци и неполны х антител соответствующими агглютиногенами высохшей крови.
В процессе опытов были применены 8 оригинальных вариантов этой реакции, причем в одном из них абсорбция агглютининов сочеталась с непрямой пробой Кумбса, а в другом исследуемые объекты (пятна крови и контрольные участки марли) и стандартные эритроциты обрабатывались ферментом трипсином. Кроме того, использовалась техника реакции, предложенная Рюфье и Дюко3 для полных антител (агглютининов) анти-резус.
Ни один из вариантов реакции абсорбции неполных антител типа агглютиноидов, равно как и полного антитела в присутствии неполного, не позволил выявлять агглютиногены изосерологической системы резус в высохшей крови с той степенью достоверности, которая требуется при судебномедицинских исследованиях.
Полученные данные подтверждают мнение Рюфье и Дюко, что сыворотки, содержащие неполные антитела анти-резус или полные и неполные антитела совместно, практически непригодны для определения резус- принадлежности высохшей крови.
Заслуживает дальнейшего изучения использование в реакции абсорбции неполных антител (агглютиноидов) трипсинизированных стандартных эритроцитов, что дает возможность при разведении сывороток в процессе их титрования заменить высокомолекулярную среду физиологическим раствором.
1 Обнаружение агглютиногенов системы Льюис в жидкой крови см. М. А. Бронникова, В. А. Багдасаров, Л. О. Барсегянц. Советская антропология, 1957, № 2, стр. 249.
2 Fis k and Мс Gee . Amer. J. Clin. Path., 1947, 17, 737.
3 Ruffl e et Ducos . Ann. med. legale, 1952, N. 5, p. 351.
похожие статьи
Обнаружение эклипсных антигенов в трупной крови / Локтева Р.В. // Избранные вопросы судебно-медицинской экспертизы. — Хабаровск, 2019. — №18. — С. 127-131.