Судебно-медицинская диагностика причины смерти и установление танатогенеза морфологическими методами
/ Богомолов Д.В., Богомолова И.Н., Путинцев В.А., Баранова М.Я., Кульбицкий Б.Н., Павлов А.Л., Фетисов В.А., Букешов М.К. — 2012.

Судебно-медицинская диагностика причины смерти и установление танатогенеза морфологическими методами : методические рекомендации / Богомолов Д.В., Богомолова И.Н., Путинцев В.А., Баранова М.Я., Кульбицкий Б.Н., Павлов А.Л., Фетисов В.А., Букешов М.К. — М.: ФГБУ РЦМСЭ, 2012.
Методические рекомендации позволяют по результатам комплексного морфологического изучения внутренних органон устанавливать тот или иной тип танатогенеза, что в совокупности с другими данными указывает на вид смерти.
Рассмотрена диагностика танатогенеза при хронической алкогольной интоксикации, ишемической болезни сердца, переживании черепно-мозговой травмы и некоторых отравлениях, как наиболее актуальных видах смерти.
Методические рекомендации предназначены для судебно-медицинских экспертов.
Методические рекомендации подготовлены сотрудниками лаборатории морфологических исследований ФГБУ РЦСМЭ: заведующим д.м.н. Д.В. Богомоловым, ведущим научным сотрудником к.м.н. И.Н. Богомоловой, ведущим научным сотрудником к.м.н. В.А. Путинцевым, старшим научным сотрудником к.м.н. М.Я. Барановой, м.н.с. Б.Н. Кульбицким, а также судебно-медицинским экспертом БСМЭ ДЗ г. Москвы А.Л.Павловым, зав. отделением ФГБУ РЦМСЭ д.м.н. В.А. Фетисовым, начальником БСМЭ г. Байконур М.К. Букешовым.
Рецензент: В.П.Конев - заведующий кафедрой судебной медицины с курсом правоведения Омской государственной медицинской академии, доктор медицинских наук, профессор
Рекомендовано к изданию Ученым советом ФГБУ «РЦСМЭ» Минздравсоцразвития России (протокол № 2 от 29.03.2012 г.).
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ УЧРЕЖДЕНИЕ
«РОССИЙСКИЙ ЦЕНТР СУДЕБНО-МЕДИЦИНСКОЙ ЭКСПЕРТИЗЫ»
МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ И СОЦИАЛЬНОГО РАЗВИТИЯ
РОССИЙСКОЙ ФЕДЕРАЦИИ
(125284, г. Москва, ул. Поликарпова, д.12/13)
«Утверждаю»
И.о. директора ФГБУ «РЦСМЭ»
Минздравсоцразвития России,
доктор медицинских наук
__ А.В. Ковалев 29 марта 2012 г.
СУДЕБНО-МЕДИЦИНСКАЯ ДИАГНОСТИКА ПРИЧИНЫ СМЕРТИ И
УСТАНОВЛЕНИЕ
ТАНАТОГЕНЕЗА МОРФОЛОГИЧЕСКИМИ МЕТОДАМИ
(Методические рекомендации)
Москва 2012
Аннотация:
Методические рекомендации позволяют по результатам комплексного морфологического изучения внутренних органон устанавливать тот или иной тип танатогенеза, что в совокупности с другими данными указывает на вид смерти.
Рассмотрена диагностика танатогенеза при хронической алкогольной интоксикации, ишемической болезни сердца, переживании черепно-мозговой травмы и некоторых отравлениях, как наиболее актуальных видах смерти.
Методические рекомендации предназначены для судебно-медицинских экспертов.
Методические рекомендации подготовлены сотрудниками лаборатории морфологических исследований ФГБУ РЦСМЭ: заведующим д.м.н. Д.В. Богомоловым, ведущим научным сотрудником к.м.н. И.Н. Богомоловой, ведущим научным сотрудником к.м.н. В.А. Путинцевым, старшим научным сотрудником к.м.н. М.Я. Барановой, м.н.с. Б.Н. Кульбицким, а также судебно-медицинским экспертом БСМЭ ДЗ г. Москвы А.Л.Павловым, зав. отделением ФГБУ РЦМСЭ д.м.н. В.А. Фетисовым, начальником БСМЭ г. Байконур М.К. Букешовым.
Рецензент: В.П.Конев - заведующий кафедрой судебной медицины с курсом правоведения Омской государственной медицинской академии, доктор медицинских наук, профессор
Рекомендовано к изданию Ученым советом ФГБУ «РЦСМЭ» Минздравсоцразвития России (протокол № 2 от 29.03.2012 г.).
ВВЕДЕНИЕ
Данные методические рекомендации предлагается впервые. В отличие от предыдущих подходов они применяют комплекс морфологических методов, позволяющих провести специальный танатогенетический анализ, используемый при проведении судебно-медицинских экспертиз для диагностики причины смерти. Эта цель достигается предложенной в данных методических рекомендациях судебно-медицинской диагностикой причины и танатогенеза морфологическими методами, учитывая существенные особенности при различных видах смерти.
Предлагаемый комплексный морфологический метод является новым и не имеет отечественных и зарубежных аналогов.
Практические учреждения, в которых рекомендуется осуществить реализацию данных методических рекомендаций - Бюро судебно-медицинской экспертизы Российской Федерации.
ПОКАЗАНИЯ К ПРИМЕНЕНИЮ МЕТОДИЧЕСКИХ РЕКОМЕНДАЦИЙ
- Судебно-медицинское исследование трупа при необходимости установления темпа умирания, типа танатогенеза и вида смерти.
-
Судебно-медицинское исследование трупа с целью установления диагноза.
ПРОТИВОПОКАЗАНИЯ К ПРИМЕНЕНИЮ МЕТОДИЧЕСКИХ РЕКОМЕНДАЦИЙ
Абсолютные противопоказания:
-
Судебно-медицинское исследование трупов с поздними трупными изменениями, исключающими гистологическое исследование.
-
Судебно-медицинское исследование трупов с выраженными последствиями взрывной травмы (значительно фрагментированными), выражение обгоревшими и скелетированными.
Относительное противопоказание.
Смерть в условиях очевидности, не связанная с необходимостью установления её причины, типа и темпа танатогенеза.
МАТЕРИАЛЬНО-ТЕХНИЧЕСКОЕ ОБЕСПЕЧЕНИЕ МЕТОДА
Предлагаемые методические рекомендации не требуют специальных технических средств, достаточно штатного оснащения Бюро судебно-медицинской экспертизы. Для проведения исследования применяют стандартное оборудование и реактивы танатологических отделений и судебно-гистологических лабораторий Бюро судебно-медицинской экспертизы:
-
Стандартное оборудование для вскрытия трупа.
-
Стандартные аппаратура, материалы, реактивы, используемые для проведения судебно-гистологического исследования.
ОПИСАНИЕ МЕТОДА
В процессе вскрытия и последующего судебно-гистологического исследования трупа, помимо стандартных действий на этапе судебно-гистологического исследования проводятся следующие специальные мероприятия, необходимые для установления типа танатогенеза (т.н. танатогенетический анализ):
Для головного мозга.
-
• Деструктивный отек с вовлечением ядер ствола мозга.
-
• Кровоизлияния и иные деструктивные процессы с разрушением жизненно важных отделов мозга.
-
• Тяжелые изменения более половины магноцитов гигантоклеточного ядра ствола головного мозга и др. подобные.
Для сердечной мышцы.
-
• Инфарцирование или др. необратимые изменения более половины кардиомиоцитов при репрезентативном заборе материала.
-
• Распространенные на значительной площади зоны фрагментации, контрактурных повреждений 2-3 ст., миоцитолиза, гиперрелаксации или же глыбчатого распада кардиомиоцитов.
Для легких.
- • Отек с вовлечением более половины альвеол.
-
• Воспалительная инфильтрация и экссудация в альвеолы более чем на !/2 площади препаратов.
-
• Рестриктивные процессы большой распространенности.
-
• Ателектазы с вовлечением значительной доли альвеол или же со смещением органов средостения и другие подобные.
-
• Обструкция верхних дыхательных путей.
Для надпочечников.
-
• Кровоизлияния или иные повреждения, захватывающие более половины паренхимы.
-
• 2-х сторонние первичные опухоли или метастазы такого же распространения.
-
• Цитолиз паренхимы коры на значительной площади срезов и другие подобные.
Для печени.
-
• Массивные лобулярные некрозы любого происхождения.
-
• Механические повреждения с разрушением более половины репрезентативно изъятой паренхимы органа.
-
• Первичные и вторичные опухолевые поражения значительной распространенности
-
• Холестаз со значительными площадями повреждения гепатоцитов.
Для поджелудочной железы.
-
• Очаги панкреанекроза значительной протяженности,
-
• Воспалительные изменения, занимающие большую площадь паренхимы,
-
• Опухолевые и фибротические процессы, ведущие к недостаточности экзо- и/или эндокринной паренхимы.
Для почек.
-
• Некротический нефроз со значительной распространенностью поражения канальцев.
-
• Гломерулонефрит с субтотальным блоком кровотока по клубочковым капиллярам.
-
• Значительные повреждения иной природы (воспаления, кровоизлияния).
Для системы микроциркуляции.
-
• Наличие признаков синдрома диссеминированного внутрисосудистого свертывания в виде распространенных фибриновых, гиалиновых и прочих тромбов.
Подчеркнем, что получение достоверного танатогенетического суждения связано в значительной мере с правильностью забора материала и его репрезентативного представления в препаратах.
II. Следующий этап танатогенетического анализа сводится к двум формальным операциям.
Ранжирование суммированных ТК по органам и их по величине.
-
• ТК=0 (0%),
-
• ТК=0-0,25 (25%),
-
• ТК=0,25- 0,5 (25-50%),
-
• ТК=0,5 -0,75 (50-75%),
-
• ТК=0,75- I (75-100%),
-
• ТК=1 (100%).
Наконец, далее можно приступить к формулировке танатогенетического суждения с учетом ТК. При наличии двух и более вариантов танатогснсча с близкими величинами ТК следует проанализировать возможность их сочетания и взаимосвязи.
РЕЗУЛЬТАТЫ ИСПОЛЬЗОВАНИЯ МЕТОДА
Установив тип танатогенеза, с учетом привходящих следственных и морфологических данных определяют вид и причину смерти. Далее изложение ведется по группам причин смерти.
Отравления
I. Наиболее частый вариант
танатогенеза при отравлениях - мозговой при первичном токсическом или вторичном поражении мозга.
Все яды, угнетающие функцию ЦНС, в смертельных концентрациях вызывают гибель крупных нейронов, особенно в ретикулярной формации ствола, распознаваемую по кариопикнозу или карио-лизису. Некоторые яды вызывают особое поражение мозга в виде множественных микроскопических очаговых разрежений белого вещества и изменения его тинкториальных свойств - оно становится базофильным. Особенно типична такая картина для подкорковых ядер у лиц, погибших от отравления монооксидом углерода, но она возможна также при действии гипотензивного препарата каптоприл и феназепама. И, наконец, при выраженном отеке мозга формируются острые микрокисты его ткани, как проявление деструктивного отека. Макроскопически в этих случаях отмечается его резкий отек, иногда с бороздами вклинения.
II. Сердечный тип танатогенеза
Некоторые яды обладают выраженным прямым кардиотоксическим действием, признаки которого можно обнаружить посмертно при судебно-гистологическом исследовании. Это едкие яды, нитриты, лекарства, или обладающие холинолитическим действием, барбитураты, фосфорсодержащие ядохимикаты и технические жидкости со свойствами растворителей, действующие преимущественно на сердечно-сосудистую систему (ацетон, этиленгликоль, дихлорэтан, компоненты клея БФ, метанол, этанол).
Признаки токсической миокардиодистрофии отсутствуют или выражены слабо при отравлениях угарным газом, лекарствами, действующими преимущественно на нервную систему и не имеющими холинолитического действия (например, бензодиазепинами), наркотиками-опиатами без примесей лекарств, грибными ядами, высшими спиртами.
Анализ клинических и электрокардиографических данных показал, что описанные нами изменения сердца проявляются картиной, так называемого экзотоксического шока (острой сердечно-сосудистой недостаточностью) и нарушениями сердечною ритма по типу нарушений проводимости вплоть до асистолии или, чаще, по типу экстрасистолии с исходом в фибрилляцию желудочков.
Токсическая миокардиодистрофия макроскопически проявляется расширением полостей сердца и дряблостью миокарда.
Гораздо более информативны изменения миокарда, выявляемые гистологически. Помимо поляризационной микроскопии, их можно обнаружить посредством фазового контраста или используя микроскоп с мощным осветителем и почти закрытой диафрагмой. Различению тонких изменений миокарда в световом микроскопе способствует целлоидиновая заливка препаратов.
При микроскопии можно обнаружить следующие повреждения кардиомиоцитов:
-
1) Вакуольная дистрофия. Выявляется в виде оптических просветлений по обе стороны от ядра, сужающихся по мере удаления от него. При ее нарастании развивается миоцитолизис — локальное исчезновение структур и постепенное растворение цитоплазмы. Если при этом развивается фрагментация мышечных волокон, то края фрагментов нечеткие, как бы тающие. Миоцитолизис характерен для острых отравлений этанолом; но наблюдается также при отравлениях метанолом, едкими ядами, сердечными гликозидами, барбитуратами и техническими жидкостями (этиленгликолем, дихлорэтаном, клеем БФ т.д.).
-
2) Глыбчатый и зернистый распад кардиомиоцитов. Выглядит как наличие на месте части кардиомиоцита отдельных фрагментов его, диаметр которых меньше толщины кардиомиоцита. Наблюдается при отравлениях едкими ядами, лекарствами, действующими преимущественно на сердечно-сосудистую систему (антиангинозными, гипотензивными, сердечными гликозидами), а также лекарствами с холинолитическим действием (димедрол, амитриптилин, производные фенотиазина), фосфорсодержащими ядохимикатами и нитритами.
- 3) Волнообразная деформация кардиомиоцитов. Распространенная или крупноочаговая волнообразная деформация (более 1/3 площади препарата) типична для тех же отравлений, что и распад мышечных волокон, а также для отравлений наркотиками, при которых установить яд судебно-химическим путем иногда не удается. Фрагментация в исходе этого и предыдущего процессов легко узнаваема по четким, но неровным, как бы рваным краям фрагментов.
-
4) Диссоциация кардиомиоцитов — расширение вставочных дисков вплоть до полного разъединения смежных волокон. Края разделившихся фрагментов бывают четкие и ровные, перпендикулярные длинной оси волокон. Данный тип изменений также типичен для отравлений едкими ядами, но он же обнаруживается при действии растворителей (ацетона и т.д.), особенно при ингаляционных отравлениях и иногда при действии лекарств, действующих на сердечно-сосудистую систему. Этот же тип изменений кардиомиоцитов обнаруживается при смерти от термического и травматического шока.
- 5) Трещины кардиомиоцитов. Отличаются от распада отсутствием мелких фрагментов, от диссоциации — неровностью краев разделения частей кардиомиоцита и хаотичностью расположения. Они наблюдаются при отравлениях комбинацией барбитуратов и бензодиазепинов.
Все пять процессов не только сами по себе нарушают функцию кардиомиоцитов или отражают ее нарушение, но и приводят в финале к фрагментации мышечных волокон.
III. Легочный танатогенез при отравлениях встречается в следующих вариантах.
1) Массивный альвеолярный отек легких с кровоизлияниями отмечается при медленном умирании. Существенных различий в действии различных ядов на наличие и выраженность отека нет.
2) Долевая клебсиеллезная пневмония — при отравлениях суррогатами алкогольных напитков. Особенности клебсиеллезной пневмонии включают отсутствие поражения бронхов, верхнедолевую локализацию и несколько слизистую консистенцию экссудата.
3) Гнойная бронхопневмония. Ею осложняются отравления лекарствами (особенно угнетающими центральную нервную систему, значительно реже — кардио- и вазотропными), суррогатами алкогольных напитков, едкими ядами, опиатами, растворителями, фосфорорганическими ядохимикатами, пиретроидами. Чаще всего бронхопневмония развивается у пострадавших в стационаре через 1-25 суток после поступления и ввиду двустороннего поражения и сливного или абсцедирующего характера нередко становится непосредственной причиной смерти или, по крайней мере, играет заметную роль и танатогенезе.
4) Аспирационная пневмония отличается тяжелым течением, бывает двусторонней субтотальной или сливной полиацинарной, осложняется абсцедированием. Отравления, наиболее часто приводящие к аспирации рвотных масс, вызываются уксусной кислотой, суррогатами алкогольных напитков и лекарствами, угнетающими нервную систему.
5) Интерстициальная гнойно-фибринозная пневмония. В 5% наблюдений пневмония имеет столь своеобразный характер, что ее нельзя назвать ни крупозной, ни бронхопневмонией. Бронхи остаются интактными, в альвеолах развивается отек, выпадает фибрин, в капиллярах и более крупных сосудах повышается количество лейкоцитов, отмечается их краевое стояние и диапедез в альвеолы по типу интерстициальной пневмонии. В некоторых случаях, у героиновых наркоманов, отмечается также диапедез эозинофилов.
Гнойно-фибринозная пневмония по типу интерстициальной наиболее типична для действия опиатов, эфедрона, едких и грибных ядов, хотя может встречаться и при иных видах отравлений, обычно в сроки от 12 часов до 11 суток пребывания в стационаре.
6) Респираторный дистресс-синдром. В ряде случаев клинически диагностируется респираторный дистресс-синдром, токсический отек легких или острая дыхательная недостаточность. Клиника характерна: чувство нехватки воздуха, учащенное дыхание (иногда до 30 движений в минуту в покое), разлитой цианоз при скудных физикальных и рентгенологических данных (жесткое дыхание и усиление сосудистого рисунка), иногда также выделение пены изо рта и обильные влажные разнокалиберные хрипы над всей поверхностью легких при отсутствии признаков пневмонии.
Морфологические проявления легочного дистресс-синдрома:
-
- отек легких с выраженной эозинофилией транссудата, свидетельствующей об обилии белков
-
- наличие дистелектазов
-
- выпадение в альвеолах фибрина в виде эозинофильных сетчатых масс
-
- его организация в гиалиновые мембраны и тельца - гомогенные ярко эозинофильные образования, выстилающие альвеолы изнутри или свободно лежащие в их просвете
-
- к концу 1 - началу 3 суток присоединяется пневмония, наиболее типична гнойно-фибринозная интерстициальная.
Токсический отек легких и респираторный дистресс-синдром клинически манифестируют как острая дыхательная недостаточность и представляют собой стадии одного процесса. Тяжелый респираторный дистресс-синдром часто встречается при отравлениях любыми едкими ядами, не этиловыми одноатомными спиртами, лекарствами (чаще кардио- и вазотропными либо с холинолитической активностью типа димедрола и амитриптилина), редко — растворителями, опиатами, грибными ядами, ядохимикатами.
При быстрой смерти, действии опиатов, лекарств, угнетающих нервную систему, метгемоглобинобразователей и монооксида углерода смерть наступает в стадию выпадения фибрина в альвеолах, до образования гиалиновых мембран.
7) Сосудистые поражения легких — тромбоэмболия ветвей легочной артерии, приводящая к смерти (типична для отравлений лекарствами, угнетающими ЦНС), тромбоэмболия мелких ветвей легочной артерии, влекущая за собой инфаркты легких (при отравлениях лекарствами, угнетающими ЦНС, суррогатами алкогольных напитков и опиатами), микротромбозы как легочные проявления синдрома диссеминированного внутрисосудистого свертывания и, наконец, изолированные микротромбозы сосудов легких, соответствующие понятию синдрома локального внутрисосудистого свертывания.
Развернутый синдром диссеминированного внутрисосудистого свертывания (микротромбы в трех и более органах с проявлениями геморрагии) с поражением легких может быть связан с пневмонией, но в ее отсутствие типичен для отравления метгемоглобинобразователями, ядохимикатами, опиатами, неэтиловыми одноатомными спиртами и дихлорэтаном, а также для действия уксусной кислоты, но не других едких ядов.
Изолированные микротромбозы сосудов легких, соответствующие понятию синдрома локального внутрисосудистого свертывания, также встречаются при отравлениях метгемоглобинобразователями, монооксидом углерода, едкими ядами, часто наблюдаются и при действии этанола.
8) Наиболее редким токсическим поражением легких является бронхоспазм при введении фальсифицированных или плохо очищенных наркотиков внутривенно или при действии фосфорорганических ядохимикатов. Нередко такой спазм можно интерпретировать как одно из органных проявлений анафилактического шока.
Для подтверждения печеночного танатогенеза необходимо выявить массивный (мостовидный или лобулярный) некроз ткани этого органа.
Не всегда удается провести четкую грань между дистрофией, очаговым и диффузным некрозом, поскольку эти состояния являются не разными процессами, а стадиями одного. Дистрофия любого типа начинается как диссеминированная моноцеллюлярная, то есть в отдельных клетках, потом становится очаговой и затем — диффузной. Некроз сначала также бывает моноцеллюлярным диссеминированным (ступенчатым), затем, при прогрессировании процесса, становится очаговым (мостовидным), а при дальнейшем нарастании тяжести поражения — массивным (лобулярным и диффузным).
IV. Более целесообразно подразделять токсические поражения печени по патологическому процессу, лежащему в основе патогенеза.
1) Нарушения кровообращения. Благодаря современным методам лечения инфаркты печени в настоящее время встречаются крайне редко. В противоположность этому, микротромбы в сосудах этого органа обнаруживаются чаще, чем в иных, что, видимо, связано с пероральным приемом большинства ядов и соответственно их более высокой концентрацией в сосудах воротной системы печени.
2) Нарушения отделения желчи — холестаз. Его макроскопическим эквивалентом служит желтуха. Внепеченочный холестаз имеет токсическую природу казуистически редко. Внутрипеченочный холестаз на уровне протоков, проявляющийся их пролиферацией, характерен для гепатита наркоманов, который имеет вирусно-токсическую природу. Внутрипеченочный холестаз на уровне желчных капилляров (проявляется их расширением и наличием в них пигментных цилиндров) и гепатоцитов (в виде отложения гранул пигмента в цитоплазме гепатоцитов) - главное проявление отравления суррогатами алкогольных напитков, содержащих диэтилфталат и полигексаметиленгуанидин гидрохлорид (спиртовой раствор «Экстрасепт-1»), встречается также при длительном приеме нейролептиков. Внутрипеченочный холестаз на уровне гепатоцитов иногда сопровождает массивный некроз паренхимы печени или является его причиной.
3) Гидропическая и баллонная дистрофия с переходом в колликвационный некроз гепатоцитов. Такая форма поражения наиболее типична для отравлений гликолями, но в связи с усовершенствованием методов лечения пострадавших почти не встречается. Иной причиной отсутствия на практике такого поражения может служить различие действия гликолей: этиленгликоль вызывает тяжелое повреждение почек с отложением кристаллов оксалатов и особый тип менингита с кристаллами оксалатов в субарахноидальных сосудах, но не поражение печени. В противоположность этому, диэтиленгликоль и диметилгликоль вызывают некронефроз и перицентральную гидропическую дистрофию печени, но при них нет оксалатов и менингита.
Очаговая гидропическая дистрофию и колликвационный некроз наблюдается при отравлениях монооксидом углерода, суррогатами алкогольных напитков, полианионной щелочью (жидкость «Крот» для очистки сантехники), нитритами, фосфорсодержащими ядохимикатами и дильдрином (хлорсодержащим ядохимикатом). Очаги располагаются на удалении от центральной вены; перицентральный некроз был обнаружен только при отравлении полианионной щелочью.
4) Жировая дистрофия с исходом в жировой некроз. Такой тип поражения встречается значительно чаще. По нашим данным, он типичен для отравлений дихлорэтаном и бледной поганкой, причем жировая дистрофия и некроз достигают наибольшей выраженности в центре долек. При действии едких ядов мелкокапельная жировая дистрофия обнаруживается, напротив, перипортально. Диссеминированная или диффузная жировая дистрофия, иногда с моноцеллюлярными некрозами наблюдается при отравлениях лекарствами (барбитураты, бензодиазепины и другие), растворителями и нитритами. Суррогаты алкогольных напитков, содержащие диэтилфталат и полигексаметиленгуанидин гидрохлорид (спиртовой раствор «Экстрасепт- 1»), иногда вызывают диффузную крупнокапельную жировую дистрофию с очаговыми некрозами. Однако в этих случаях нельзя исключить развитие острого отравления на фоне жирового гепатоза, обусловленного хронической интоксикацией.
5) Иногда некроз гепатоцитов развивается без предшествовавшей дистрофии, и первым его проявлением служит кариолиз, а потом и границы всей клетки становятся нечеткими и она как бы растворяется. При действии едких ядов зоны некроза расположены перипортально, при остальных отравлениях - перицентрально. Токсины бледной поганки и тетрахлорметан вызывают тотальный некроз печени, но начинается он с центров долек. Гепатотропные суррогаты алкогольных напитков и лекарства поражают центральные и средние части долек органа.
6) Апоптоз — программируемая смерть клеток. При отравлениях его интенсивность повышается, вследствие чего он становится хорошо заметным в гистологических препаратах. Предшествует ему обычно усиление эозинофилии цитоплазмы и ее гомогенизация. Затем пораженный гепатоцит теряет ядро, приобретает шарообразную форму и выталкивается из печеночной балки вместе с обломками ядер в перисинусоидальное пространство, где и лизируется макрофагами в виде т.н. апоптозных телец. Этот процесс обнаруживается при отравлениях гепатотропными суррогатами алкогольных напитков, растворителями (дихлорэтан, этиленгликоль), лекарствами (барбитураты).
Воспалительные реакции на токсические поражения печени обычно выражены слабо, и в них участвуют преимущественно макрофаги, что объясняется асептическим характером поражения. В случаях массивного некроза развивается и лейкоцитарная реакция. При отравлениях бледной поганкой в зонах некроза, особенно по их периферии, отмечаются активация ретикулоэндотелия и лимфо-макрофагальная инфильтрация с примесью сегментоядерных нейтрофилов.
Нарушения регенерации заметны при массивном некрозе и поздней смерти и проявляются разнообразием размеров гепатоцитов и их ядер. При отравлениях бледной поганкой можно наблюдать пролиферацию сосудов, желчных протоков и печеночных балок по периферии портальных трактов. У выживших после массивного некроза печени формируется ее цирроз.
V. Токсические поражения почек также удобно подразделять по патологическому процессу, лежащему в основе патогенеза.
1) Нарушения кровообращения. Инфаркты почек при отравлениях развиваются только в результате септикопиемии. Классическая картина гликолевого нефроза в настоящее время встречается крайне редко, обычно дело ограничивается единичными микрокровоизлияниями. Микротромбы в сосудах этого органа обнаруживаются при синдроме диссеминированного внутрисосудистого свертывания различного генеза.
2) Токсическая гломерулопатия — форма острого токсического поражения почек, при которой в просветах капсул клубочков обнаруживается фибрин, иногда с примесью эритроцитов, а в тяжелых случаях капилляры клубочка подвергаются фибриноидному некрозу. Такая картина встречается при отравлении тетраэтилсвинцом.
3) Пигментный нефроз. Макроскопически он проявляется темными полосками на разрезе почки, микроскопически — пропитыванием нефротелия канальцев пигментом, его некрозом и формированием пигментных цилиндров. Отложение в почках желчных пигментов — главное проявление отравления суррогатами алкогольных напитков, содержащих диэтилфталат и полигексаметиленгуанидин гидрохлорид (спиртовой раствор «Экстрасепт-1»). Оно встречается и при массивном некрозе печени, но выражено значительно слабее. Особенность желчных пигментов — в разнообразии их цветов: они могут быть желтыми, красноватыми, зелеными, коричневыми и темными, почти черными.
Пигментный нефроз выявляется также при гемолизе и миолизе, когда в почках откладываются гемо- и миоглобин. Гемолиз типичен для отравления уксусной и в меньшей степени прочими кислотами, метгемоглобинобразователями и гемолитическими ядами (например, сульфат меди). Миоглобинурия наблюдается при длительных коматозных состояниях, особенно вне стационара (отравления этанолом, суррогатами алкогольных напитков, опиатами, лекарствами, угнетающими ЦНС, монооксидом углерода).
Первая стадия выделительного нефроза — фильтрация пигмента клубочками — на трупах не обнаруживается. При ранней смерти определяется пропитывание цитоплазмы нефротелия. Далее формируются цилиндры, причем существует три пути их образования:
- А) из апикальных частей нефротелия, пропитанных пигментом,
-
Б) из слущенных клеток нефротелия, целиком подвергшихся некрозу или апоптозу,
- В) из эритроцитов, попавших в просвет канальца при нарушении проницаемости сосуда.
На гибель нефротелия развивается клеточная реакция.
Особо следует обсудить так называемый синдром базальной инкрустации нефротелия (БИН-синдром), который, по мнению некоторых авторов, специфичен для отравлений этанолом. Мы не встретили его при отравлениях этанолом, но наблюдали при других отравлениях (другими спиртами, этиленгликолем, дихлорэтаном) и даже при их отсутствии. В подавляющем большинстве случаев это артефакт, обусловленный неравномерным выпадением формалинового пигмента, и диагностического значения не имеет. Однако изредка при внутрисосудистом гемолизе встречается истинный — прижизненный БИН-синдром.
4) Гидропическая и баллонная дистрофия с переходом в колликвационный некроз нефротелиоцитов. Если гидропическая дистрофия может встретиться при любом отравлении, то ее переход в баллонную и некроз пораженных клеток наиболее характерны для гликолей.
5) Жировая дистрофия нефротелия отличается округлой формой вакуолей и их четкими границами. Такой тип поражения тоже встречается нечасто и наблюдается при отравлениях лекарствами (клофелин, барбитураты, димедрол), суррогатами алкогольных напитков, этиленгликолем, дихлорэтаном, уксусной кислотой и сулемой. К некрозу пораженных клеток приводит редко.
6) Гиалиново-капельная дистрофия нефротелия наиболее характерна для действия едких ядов и представляет собой парциальный некроз апикальных частей клеток, который может перейти в некроз всей клетки.
7) Иногда некроз нефротелиоцитов развивается без предшествовавшей дистрофии, и первым его проявлением служит кариолиз, а потом и границы всей клетки становятся нечеткими и она отделяется от базальной мембраны и от других клеток. Иногда клетки слущиваются пластами. Однако макроскопически такой четкой картины некротического нефроза, как описана в старой литературе, в настоящее время не бывает. Отмечается лишь бледность коры.
8) Особым видом минеральной дистрофии почек можно считать образование в их канальцах кристаллов. Чаще всего это кристаллы оксалатов при отравлении этиленгликолем. Но они могут образовываться и при отравлении щавелевой кислотой или тетрахлорметаном. В последнем случае из-за поражения печени кристаллы окрашиваются желчными пигментами в темный цвет.
Т.о. выявив те или иные танатогенетически значимые поражения внутренних органов можно предполагать тот или иной вид отравлений.
Пример: В автомобиле обнаружен труп мужчины на вид 40-45 лет без видимых на первый взгляд признаков насильственной смерть. При наружном исследовании кожные покровы трупа ярко розового цвета, трупные пятна — разлитые синюшно-фиолетового цвета. При вскрытии:
Легкие карминового цвета, на разрезах макроскопически умеренно выраженный отек; микроскопически отек на 1/3 площади представленных препаратов. (Тк-0,33) в головном мозге и стволе микроскопически ишемия и кариолиз 2/3 нейронов на представленных препаратах. (Тк-0,75) В сердце микроскопически фрагментация кардиомиоцитов на '/2 площади представленных препаратов. В микроциркуляторном русле всех представленных препаратов в 80% сосудов фибриновые тромбы. (Тк-0,8) При вскрытии от органов трупа ощущался запах алкоголя. Учитывая данные наружного осмотра и вскрытия, не имея данных гистологического исследования, эксперт может заподозрить отравление угарным газом, и (или) отравление этанолом (суррогатами) — для подтверждения необходим судебно-химический анализ крови на угарный газ, на алкоголь.
В крови при анализе на угарный газ — 40%
При газохроматографическом анализе в крови- 4,5 ‰ и примесь суррогатов алкоголя при обще-химическом исследовании крови. Из сравнения коэффициентов мы видим что танатогенез, комбинированный с преобладанием коагулопатии (что является характерным признаком при отравлении суррогатами алкоголя).
При постановке судебно-медицинского диагноза, с учетом полученных коэффициентов:
-
1) Комбинированное отравление этанолом и суррогатами алкоголя.
-
2) Отравление угарным газом.
Переживание черепно-мозговой травмы
Танатогенез при переживании черепно-мозговой травмы зависит не только от тяжести и вида ЧМТ, но и от срока её переживания.
1) При смертельной ЧМТ при смерти на месте происшествия непосредственной причиной смерти являются первичные разрушения жизненно важных структур мозга или ранние кровоизлияния в стволовой отдел мозга, что связано с острыми нарушениями ликвородинамики. Заметную роль в танатогенеза также играют повреждения черепно-мозговых нервов. Танатогенез в первые часы переживания ЧМТ, как правило мозговой.
2) При смертельной ЧМТ при смерти до суток непосредственной причиной смерти являются отек мозга и его набухание либо вследствие ушибов, либо от нарастающих подоболочечных гематом, что ведет к дислокации мозга и возникновению смертельных вторичных кровоизлияний в стволовую часть мозга. На этих сроках закономерно развитие отека легких с трансформацией его в легочный дистресс-синдром. Т.е. наблюдается конкуренция мозгового и легочного танатогенезов.
3) На промежутке от суток до недели происходит перемена типа танатогенеза на легочный (пневмонии). Реже встречаются мозговые инфекционные осложнения, ДВС-синдром (коагулопатический танатогенез) и отсроченные дислокационные синдромы (вторичный мозговой танатогенез). При повреждении 10-ой пары нервов возможно ранее развитие некротической долевой пневмонии, т.н. вагусной пневмонии.
4) При переживании недели до месяца чаще всего причиной смерти являются либо гнойно-септические (абсцедирующая пневмония, восходящая уроинфекция и др.), либо трофические патологические состояния. Как правило, для этих сроков характерен комбинированный танатогенез.
5) Поздними осложнениями ЧМТ является посттравматическая кахексия, вегетативное состояние или же эпилептические явления при возникновении оболочечных спаек и кист.
6) Субстратом развития пневмоний при переживании ЧМТ является легочный дистресс-синдром.
7) При смерти на догоспитальном этапе от тупой черепно-мозговой травмы отек легких с трансформацией его в легочный дистресс-синдром является одним из показателей темпа ее наступления. Отсутствие отека легких при такой смерти свидетельствует об очень коротком сроке умирания. При этом потерпевшие, как правило, имеют повреждения стволового отдела мозга в сочетании с повреждениями черепных нервов (X пара), шейного отдела позвоночника и спинного мозга, с переломами костей свода и основания черепа.'
Т.о. учитывая сроки переживания и вид ЧМТ вместе с типом танатогенеза, можно судить о причине смерти и темпе её наступления.
Пример: из больницы доставлен труп мужчины Н. 45 лет, из истории болезни известно, что поступил вчера в реанимационное отделение в бессознательном состоянии с ЗЧМТ тяжелой степени, через 5 часов скончался. При вскрытии: в легком макроскопически умеренно выраженный отек; микроскопически отек на 2/3 площади представленных препаратов, с присутствием фибрина. (Тк-0,75) в головном мозге и стволе микроскопически ишемия и кариолиз 2/3 нейронов, с явлениями аксональных повреждений на представленных препаратах. (Тк-0,75). В сердце микроскопически фрагментация кардиомиоцитов 1/3 площади представленных препаратов. (Тк-0,33)
При газохроматографическом анализе в крови — 2,5 ‰ алкоголя при обще-химическом исследовании крови. (Тк-0,33) (опьянение средней степени тяжести)
Из сравнения коэффициентов мы видим что танатогенез, можно воспринять как комбинированный, но ЗЧМТ является первопричиной.
При постановке судебно-медицинского диагноза, с учетом полученных коэффициентов:
- Основное: ЗЧМТ с явлениями диффузного аксонального повреждения.
- Осложнение: отек легких с начинающимся дистресс синдромом взрослых.
Смерть от хронической алкогольной интоксикации (ХАИ)
Анализ секционного материала и изучением препаратов показал, что и при хронической, и при сочетанной алкогольной интоксикации поражаются все внутренние органы: сердце, печень, почки, поджелудочная железа, легкие, головной мозг, тестикулы и др. Ведущими явились печёночная, сердечная, легочная и мозговая формы танатогенеза, на долю которых пришлось большая часть наблюдений.
Мозговая симптоматика при хронической алкогольной интоксикации в виде энцефалопатии и отёка отмечается в половине исследований, хотя как причина летального исхода (геморрагическая энцефалопатия) была отмечена лишь в двух случаях.
Мозговой тип танатогенеза при ХАИ может быть нескольких видов:
- - острое нарушение мозгового кровообращения, что может быть одним из проявлений диссеминированного внутрисосудистого свёртывания при отравлениях суррогатами этанола или при алкогенной артериальной гипертензии;
- - смерть от отёка мозга с дислокационным синдромом, что больше характерно для острого отравления и отравления высшими спиртами,
- - смерть при явлениях алкогольного делирия или вторичного симптоматического эпистатуса при хроническом слипчивом арахноидите.
Мозговой тип танатогенеза чаще связан с дистрофией и некрозом нейронов дыхательного и сосудодвигательного центров, то есть магноцитов ретикулярной формации ствола и характерен для соче-танной интоксикации, особенно с проявлениями делирия. При этом отмечается картина субарахноидальных и паренхиматозных кровоизлияний с развитием перицеллюлярного отёка, атрофии головного мозга, тяжёлых изменений в мозге в виде очаговых глиозно-клеточных пролифератов с выпадением нейронов, лизиса ядра и ядрышка. Эти изменения считаются необратимыми.
Достоверные изменения нейронов наблюдаются в стволе, коре и мозжечке при сочетанной интоксикации, а при хронической - в стволе головного мозга. Выявленные в мозге дистрофические и некротические изменения нейронов с глиальной реакцией, при наличии незначительных изменений в сердце в виде диффузного кардиосклероза, анизоцитоза и липофусциноза дает основание говорить о мозговом типе танатогенеза, то есть о поражении вегетативных ядер ствола и смерти от паралича дыхательного центра. Для коагулопатически-мозгового типа танатогенеза характерным является также коагулопатия, которая превалирует при сочетанной интоксикации с участием суррогатов этанола в сравнении с хронической алкогольной интоксикацией.
Для сочетанной интоксикации, кроме наличия большого количества тяжёлых изменений нейронов характерным явилось полнокровие коркового и мозгового вещества почек, множественные кровоизлияния, эмфизема и воспалительные явления в легких, ДВС-синдром, тромбоэмболия легочной артерии. Всё это служит косвенным критерием, подтверждающим: коагулопатический тип танатогенеза при сочетанной алкогольной интоксикации. В генезе изменений по типу острого набухания и хроматолиза с последующей гибелью клеток, возможно, играет роль и непосредственное токсическое воздействие яда. Сочетанная интоксикация алкоголем и суррогатами, с проявлением делирия почти всегда, в наших наблюдениях, завершалась комой, что можно связать с недостатком кровоснабжения из-за воспалительных, деструктивных процессов в легких, микротромбозов сосудов мозга и последующей гипоксии.
Изменения нейронов в мозге, при сочетанной интоксикации, сопряжены с изменениями в лёгких, в частности с респираторным дисстрес-синдромом с последующей трансформацией в ДВС-синдром и тромбоз и/или тромбоэмболию ветвей легочной артерии.
Причиной проявления одновременно с легочной, и мозговой симптоматики, можно считать гипоксию из-за респираторного дисстрес-синдрома и синдрома диссеминированного внутрисосудистого свёртывания. Эти явления в свою очередь вызывают отёк мозга, с последующим последовательным височно-мозжечково-тенториальным вклинением вещества мозга и воздействием на бульбарные образования. Однако, нельзя исключить и обратную последовательность развития легочно-мозгового танатогенеза с коагулопатическим компонентом: отёк мозга —> поражение дыхательного центра в продолговатом мозге —> нарушения дыхания —> респираторный дисстрес-синдром взрослых —> системная гипоксия.
Особого внимания заслуживает острая геморрагическая энцефалопатия Гайе-Вернике, которая чаще встречается при сочетанной интоксикации, особенно с проявлениями делирия. При секционном исследовании выявляются мелкие геморрагические участки, чаще в области ствола и мозжечка, в подкорковых ядрах. Характерными симптомами для неё катамнестически являются быстрое начало с нарушением сознания и прогрессирование неврологической симптоматики. Продромальный период — в виде общемозгового, вегетососудистого, гипоталамического синдромов. Появляются психические нарушения в виде классического делирия, затем период возбуждения сменяется сомноленцией, апатическим ступором, который сменяется оглушением. Почти всегда присутствуют обманы восприятия, тихий бред, бормотания. Собственно неврологическая симптоматика соответствовала патоморфологической картине. Менингеальные симптомы, или симптомы раздражения мозговых оболочек проявляются в виде ригидности затылочных мышц, симптом Кернига, симптомы Брудзинского верхний, средний, нижний, симптом Гийена, феномен Бехтерева — истинный симптом раздражения мозговых оболочек. Надо отметить, что перечисленные симптомы и синдромы встречаются обычно не в полном комплекте. Редкую диагностику геморрагической энцефалопатии, как причины смерти, судебными медиками, можно объяснить отсутствием у них клинических данных.
Наиболее часто встречающимся тяжелым психическим проявлением алкогольной интоксикации является Корсаковский психоз. Этот синдромокомплекс часто сочетается с полиневритом и нередко его называют алкогольполиневритическим психозом. Развивается он после длительного алкогольного стажа, носит вялотекущий и перманентный характер. Нередко возникает после острого алкогольного психоза. Проявляется в нарушении когнитивных функций. Вместе с тем нет явных признаков слабоумия, ядро личности сохранено. Характерна триада симптомов: амнезия, дезориентация, конфабуляции. Нарушена память на текущие события (кратковременная память), при сохранности на отдаленные (долговременная). Такого рода нарушения встречались у всех больных. Алкогольный псевдопаралич проявляется полинейропатией, вплоть до тазовых, глазодвигательных, псевдобульбарных нарушений по типу прогрессивного паралича при сифилисе. На вскрытии выявляется соответствующая морфологическая картина.
Проявлением алкогольной интоксикации являются нарушение координации вследствие дегенеративных процессов: центральной атрофии коры мозжечка, что проявляется в мозжечковой атаксией как динамической, так и статокинетической, наблюдаются катамнестический и другие неврологические проявления алкогольной интоксикации — эпилептоформные припадки, пирамидная недостаточность, вегетативные расстройства, общемозговые симптомы энцефалопатии. При морфологическом исследовании наблюдается дегенерация коры, расширение большой цистерны, углубление борозд и щелей мозжечка, расширение четвертого желудочка — признаки гидроцефалии. Эти признаки более характерны для сочетанной интоксикации.
Одним из самых грозных проявлений алкогольной интоксикации (по топике) является центральный некроз, или миелинолиз моста. Неврологические проявления этого поражения соответствуют топическому расположению ядер черепно-мозговых нервов и проводниковых путей на уровне Варолиева моста: наблюдаются глазодвигательные нарушения, парезы черепно-мозговых нервов разной степени — лицевого, отводящего, глазодвигательного нервов. В толще Варолиевого моста проходит спиноталамический путь анимальной нервной системы, поэтому наблюдаются двигательные нарушения — вялые параличи и плегии в различных сочетаниях. С этим связаны и бульбарные расстройства: как например, низкий рвотный рефлекс. Прогноз, как правило, неблагоприятный даже после прекращения алкоголизации.
Морфологическая картина изменений сердца при хронической алкогольной интоксикации, в сочетании с приёмом суррогатов в течение довольно длительного времени соответствовала начальной стадии алкогольной кардиомиопатии. При этом изменения эти были выражены не во всех волокнах, и наблюдался не весь комплекс признаков, характерный для одного повреждения. Сердечный тип танатогенеза был выявлен в 22% из 50 экспертных и клинических исследований, из них алкогольная кардиомиопатия составила всего 6%, в остальных случаях наблюдалась острая форма патологии: инфаркт миокарда, острая коронарная недостаточность, миоцитолиз, фибрилляция. Тогда как при хронической алкогольной интоксикации алкогольная кардиомиопатия составила 45,8%.
Легочной тип танатогенеза при хронической алкогольной интоксикации в практике встречается довольно редко. Чаще всего он развивался на фоне уже измененного органа и сочетался с алкогольной кардиомиопатией, то есть сердечным типом танатогенеза. При этом наблюдалось полнокровие легких, которое возникает потому, что при любой форме танатогенеза возникают явления гипоксии, и кровоток в лёгких компенсаторно увеличивается. При микроскопическом исследовании наблюдался очаговый интраальвеолярный отек, скопления лейкоцитов, в некоторых участках с отложением альвеолы фибрина, единичных фибриновых и красных тромбов в венах и капиллярах, что, по всей вероятности, предшествует образованию гиалиновых мембран. Это особенно характерно для сочетанного воздействия суррогатов на фоне хронической алкогольной интоксикации, как проявление респираторного дистресс-синдрома. Для формирования респираторного дистресс-синдрома требуется время: при быстрой смерти он не успевает развиться в полной мере. Вероятно, поэтому многолетняя хроническая интоксикация этанолом приводит и первую очередь к сердечной форме танатогенеза и довольно редко к легочной, что и было установлено в наших исследованиях. Немаловажную роль во всех этих процессах имеет нарушение синтеза сурфактанта, который вырабатывается в печени и придаст воздушность легким. Алкогольемия, в сочетании с суррогатами, влияет и на сосудистую проницаемость, в виде дисциркуляторных нарушений, прогрессирующих форм воспалительных явлений в легких и системно на выработку сурфактанта.
Из изученных показателей патологических изменений легких: воздушность, кровоизлияния, сосуды, структурные элементы достоверными оказались отёк для хронической алкогольной интоксикации и кровоизлияния для сочетанной интоксикации.
Таким образом, сочетанная интоксикация алкоголем и суррогатами вызывает воспалительные явления с тромбозами и геморрагиями в микроциркуляторном русле легких и лёгочно-мозговой тип танатогенеза, как проявление суррогатной коагулопатии. При ХАИ эти явления менее выражены и редко являются причиной смерти.
Алкогольный цирроз печени характеризовался монолобулярным, микронодулярным поражением при длительной алкоголизации, чаще при сочетанном воздействии алкоголя и суррогатов. При микроскопии видны монолобулярные узлы, вокруг которых имелись фиброзные септы, тяжи между портальными трактами. Наблюдалась и другая форма поражения — полиморфно-ядерная инфильтрация зон некроза гепатоцитов с нарастающим фиброзом, что тоже характерно для хронической алкогольной интоксикации в виде непрерывно рецидивирующего алкогольного гепатита с формированием цирроза.
Печёночный тип танатогенеза отмечается в 18,8% случаях при хронической алкогольной интоксикации и в 10% — при сочетанной интоксикации. Он проявлялся классической печеночной комой с формированием т.н. «альцгеймеровской глии» в головном мозге. Т.е. по существу такой танатогенез может быть оценен как печеночно-мозговой.
Другим механизмом умирания, как проявление портальной гипертензии, является кровотечение из расширенных вен пищевода и синдром Мэллори-Вейсса. В этих случаях была отмечена картина массивной кровопотери с ее классическими симптомами. В головном мозге наблюдался деструктивный отёк и тромбоз в сосудах микроциркуляторного русла (ДВС-синдром) в сочетании с множественными геморрагиями, что в свою очередь привело к гипоксии мозга, с последующим поражением нейронов. Эти нейрональные изменения могли быть и результатом височно-мозжечково-тенториального вклинения головного мозга из-за начавшегося отёка и сдавления нейронов бульбарных образований, например рвотных центров и раздражения участков Варолиева моста, где также имеются рвотные центры. ДВС-синдром мог бы быть отнесен за счёт кровопотери с развитием геморрагического шока, но ранний возраст тромбов и клинические показатели (ранняя олигоурия и гиперазотемия) заставляют предположить, что он развился раньше, чем кровопотеря достигла критического уровня.
В поджелудочной железе изменения не всегда выражены. Известно, что панкреонекроз, сопровождается распространенным тромбозом микроциркуляторного русла (ДВС-синдром), и чаще всего сочетается с отёком и эмфиземой легких с трансформацией в респираторный дистресс-синдром. Причина смерти — панкреатический шок, гипергликемия, или гипогликемическая кома в связи с поражением островкового аппарата железы. Панкреонекроз сопровождается множеством сливающихся фокусов жирового некроза с воспалительными явлениями вокруг, особенно при сочетанной интоксикации.
Сочетанное воздействие этанола и его суррогатов характеризуется следующим синдромами: более выраженным токсическим повреждением нейронов, особенно ретикулярной формации ствола головного мозга; преобладанием поражения нейронов головного мозга над поражением структур других органов; ДВС-синдромом с преимущественным поражением сосудов в первую очередь мозга, легких; некрозами и эрозиями слизистой оболочки пищевода и желудка; наличием не резко выраженных признаков алкогольной кардиомиопатии; частым сочетанием алкогольной болезни с респираторным дистресс-синдромом, особенно при делирии и галлюцинозе. Признаки быстрой смерти реже и выражены слабее, чем при изолированной хронической алкогольной интоксикации.
Пример: в квартире обнаружен труп женщин- 43 лет, без признаков насильственной смерти. Из амбулаторной карточки — длительное злоупотребление алкоголем и по поводу этого неоднократное лечение в наркологических стационарах.
При судебно-медицинском исследовании:
В головном мозге макроскопически слабовыраженный отек, микроскопически 1/3 нейронов с явлениями острой ишемии. (Тк-0,33).
Сердце макроскопически: дряблое с выраженным закруглением верхушки, с поверхности сильно обложено жиром, относительное увеличение массы, на фоне дистрофии неравномерной дистрофии миокарда. Микроскопически: нестенозирущий умеренно выражен ный коронароатеросклероз; неравномерная гипертрофии с дистро фией кардиомиоцитов, в 2/3 представленных препаратов кардиоми циты фрагментированы; липофусциноз цитоплазмы: умеренно выраженный липоматоз стромы и периваскулярны пространств (Тк-0,75)
Печень, макроскопически - умеренно увеличат, микроскопически -умеренно-выраженный жировой гепатоз. (Ч'к-0,1).
Поджелудочная железа в виде тяжа, неравномерно полнокровна и умеренно отечна. Микроскопически- диффузное по.'пнщю кие, неравномерный отек, слабовыраженный аутолиз. Мелкоочаговые кровоизлияния на 1/5 площади, представленных препаратов. (Тк-0,2)
Из сравнения коэффициентов мы видим, что танатогенез преимущественно сердечный.
При постановке судебно- медицинского диагноза, с учетом клинических данных и полученных коэффициентов:
1) Алкогольная кардиомиопатия на фоне хронической алкогольной интоксикации.
Смерть от ишемичсской болезни сердца
Острая коронарная смерть — вид смерти от острой ишемии ("повреждений") миокарда коронарогенного происхождения при отсутствии макро- и микроскопических признаков инфаркта миокарда.
Диагностика у секционного стола очагов острой ишемии миокарда, если от момента приступа острой коронарной недостаточности прошло менее 4-6 часов, представляет немалые трудности. В миокарде наблюдаем некоторую разрозненность окраски: ишемизированныс участки более светлые, лучше заметны в субэндокардиальных отделах, часто чередуются с участками полнокровия; иногда наблюдаются небольшие очаговые кровоизлияния. Для определения ранних стадий ишемии миокарда на секционном материале раньше рекомендовали пользоваться макрореакцией на сукцинат-дегидразу и люминесцентным макроанализом. В первом случае очаги ишемии бледные на фоне нормальной серо-синей мышечной ткани, во втором случае они люминесцируют ярким желтым цветом на темном фоне миокарда. Однако эти реакции помогают диагностике, если после приступа стенокардии смерть наступила через 4—6 часов, а вскрытие проведено не позднее 12 часов от момента смерти. Более стойкие результаты получаются при макрореакции с теллуритом калия.
При гистологическом исследовании миокарда в первые часы ишемии (до 3—6 часов) в нем можно отметить неравномерное полнокровие, иногда стазы и престазы в каппилярах, очаговые кровоизлияния, отек стромы и околоклеточных пространств. В сосудах миокарда и эпикарда отмечают очаговые плазморрагии с набуханием интимы. В субъэндокардинальных участках, наряду с нарушениями кровообращения, можно обнаружить, группы дистрофически измененных мышечных волокон, они более интенсивно окрашиваются кислыми красителями, теряют или, наоборот усиливают поперечную исчерченность. Появляются очаги так называемого дискоидного распада. Эти изменения особенно отчетливо видны в поляризационном и фазовоконтрасном микроскопах, а также при специальных окрасках препаратов, например, по Селье. Постепенно происходит набухание или сморщивание ядер поврежденных мышечных волокон, отек интерстиция миокарда.
После 6 часов в интерстициальной ткани миокарда вблизи очага ишемии появляются полиморфноядерные лейкоциты; мышечные клетки истончаются, делаются горбатыми, начинают утрачивать ядра. К концу первых — началу вторых суток инфаркт и макро- и микроскопически определяется хорошо. Он предоставляет собой очаг коагуляционного некроза, где погибают мышечные волокна, строма и кровеносные сосуды. Лейкоциты, первоначально располагающиеся на границе некроза, мигрируют в глубину очага, распадаясь и выделяя протеолитические ферменты; здесь же нередки и кровоизлияния. Преобладание обломков ядер лейкоцитов свидетельствует о стабилизации очага некроза. Наличие наряду с распавшимися обломками ядер, больших количеств свежих лейкоцитов указывает на прогрессирование процесса. Вслед за полиморфноядерными лейкоцитами на 2-3 день в демаркационной зоне появляются макрофаги, осуществляющие резорбционные процессы некроза. Таким образом, к концу первой недели в очаге некроза начинают преобладать резорбция и организация. Однако в начальной фазе, и в фазе организации картина инфаркта часто бывает пестрой: наряду со свежими участками некроза, окруженными неизменными полиморфноядерными лейкоцитами, имеются участки, где преобладают распад лейкоцитов, резорбции некротизированных участков, пролиферация сосудов и соединительнотканных клеток. К концу второй или началу третьей недели в области обширного трансмурального инфаркта миокарда можно выделить как бы 3 зоны: центр серо-желтого цвета с несколько выступающей поверхностью ("некроз"), краевая зона — желатинного вида красно-бурого цвета (грануляционная ткань). Инфаркт миокарда заживает рубцом в среднем через 1-2 месяца. У больных с далеко зашедшим стенозирующим атеросклерозом венечных артерий миокард находится в состоянии хронической гипоксии, следствием чего являются рубцовые изменения (преимущественное и субэндокардиальных отделах левого желудочка и межжелудочковой перегородки).
При внезапном увеличении потребности такого сердца в кислороде может возникнуть острая коронарная недостаточность, заканчивающаяся скоропостижной смертью или формированием инфаркта миокарда. В этих условиях вокруг рубцов обычно обнаруживают резкий отек мышечной ткани, мышечные волокна как бы удлиняются, делаются извилистыми ("горбатыми"), цитоплазма теряет структуру, окрашивается интенсивно кислыми красителями; ядра становятся пикнотичными; мышечные волокна атрофируются или лизируются, лейкоцитарная реакция выражена незначительно. Вдали от рубцов, как правило, обнаруживаются очаги глыбчатого (дискоидного) распада, коагуляционного некроза, миоцитолиза, фрагментации, иногда — очаги грануляционной ткани и мелкие рубцы. При исследовании в поляризационном и фазово-контрастном микроскопе очаги "повреждения" миокарда представляют собой участки той или иной степени патологической контракции мышечных волокон.
Иногда, когда макроскопически невозможно однозначно дать ответ о сердечном танатогенезе, однако микроскопически в миокарде мы видим признаки аритмогенной смерти, а именно обширные очаги фрагментации и глыбчатого распада в купе с контрактурными изменениями. Однозначный ответ о причине аритмогенной смерти мы дать не можем. Остается много неясного в основном вопросе о пусковых механизмах фибрилляции желудочков сердца при внезапной сердечной смерти. В наше время значительное место в генезе этого процесса стали отводить аритмогенным субстанциям (лизофосфог-лицериды, циклические аденозинмонофосфаты, свободные жирные кислоты, продукты перекисного окисления липидов, некоторые формы простагландинов), образующимся в участках гипоксии миокарда. В условиях полного прекращения кровоснабжения ишемизированного участка миокарда аритмогенные субстанции остаются в недеятельном состоянии в зоне коагуляционного некроза. При сохранении остаточного кровотока или реперфузии эти субстанции с током крови распространяются по миокарду, вызывая его фибрилляцию и нередко последующую внезапную смерть. Такое явление получило название «реперфузионной фибрилляции желудочков» и возможно, что это явление в первую очередь связано с реперфузионными вторично-кальциевыми повреждениями кардиомиоцитов. Целенаправленные исследования аритмогенных субстанций показали, что при внезапной смерти (ВС) от ИБС в миокарде желудочков, межжелудочковой перегородке и предсердий уменьшается содержание фосфолипидов при одновременном резком нарастании концентрации свободных жирных кислот. Подобные сдвиги в биохимическом составе миокарда при внезапной смерти, по их мнению, свидетельствовали о разрушении фосфолипидов мембран миокардиоцитов с образованием и накоплением лизоформ фосфолипидов (лизофосфатидилхолина и лизофосфатидилэтаноламина), свободных жирных кислот, обладающих кардиотоксическим действием с одновременным уменьшением в митохондриях миокардиоцитов содержания кальция. Накопление в митохондриях лизоформ фосфолипидов при ИБС, имеет танатогенетическое значение, так как вызывает электрофизиологические изменения миокарда с уменьшением максимального диастолического потенциала, уменьшая амплитуды и длительности потенциалов действия, его фракционирование, что в совокупности дает аритмогенный эффект.
Среди многих факторов, способствующих электрической нестабильности сердца, указывают на гипертрофию миокарда, вегетативные нарушения, гипертиреоидизм, интоксикацию этанолом, симпатомиметиками и ингибиторами моноаминоксидазы и др. По некоторым данным, морфологические проявления электрической нестабильности сердца характеризуются 1) очагами ишемии миокарда; 2) кровоизлияниями и очагами повреждения по ходу нодальных трактов синусного узла; 3) кровоизлияниями или очагами повреждения, захватывающими большинство специфических мышечных волокон одного из центральных узлов проводящей системы или узкой части ножки пучка Гиса. Эти изменения, как правило, сочетаются с признаками очагового истощения адренергической иннервации сердца с выпадением значительных участков содержания катехоламинов в нервных сплетениях миокарда при относительной сохранности в этих зонах холинергических нервных сплетений. Очевидно, поэтому на ранних сроках ишемии при внезапной сердечной смерчи не удается выявить структурных повреждений проводящей системы. В значительном числе случаев при скоропостижной смерти больных ИБС на доклиническом и раннем клиническом этапах выявляются острые изменения в сердечной мышце в виде очаговых повреждений кардиомиоцитов, приводящие к электрической нестабильности сердца и его остановке.
Изучение показало, что не всегда удастся выявить конкретные морфологические признаки, объясняющие генез летального исхода приступа аритмии, а в ряде случаев обнаруживаются как хронические, так и острые патологические изменения ткани синоатриального узла, свидетельствующие о возможном ослаблении его функции. К ним относятся:
- 1) Значительное увеличение пропорции соединительнотканного остова (фиброз или фиброэластоз узла), с одновременным уменьшением количества специализированных волокон.
- 2) Лимфоидные инфильтраты в ткани узла.
- 3) Стеноз, а в отдельных случаях — свежий тромбоз синусовой артерии.
- 4) Эозинофилия, гомогенизация и набухание саркоплазмы миоцитов, миоцитолиз отдельных специализированных волокон.
- 5) Микрокровоизлияния в окружности узла, частично проникающие в ткань узла, и окружающие нервные стволы и нервные ганглии.
- 6) Изменения нервных ганглиев, расположенных поблизости от узла — гиперхроматоз, вакуолизация, эксцентрическое смещение ядер, пикноз их и кариолизис.
При оформлении диагноза рекомендуется придерживаться следующих определений:
- - острая коронарная смерть - наличие очагов острой ишемии ("повреждений") миокарда коронарогенного происхождения при отсутствии признаков инфаркта миокарда.
- - острый (свежий) инфаркт миокарда - трансмуральный или преимущественно субэндокардиальный некроз с преобладанием деструкции миокарда (давность до 3 недель).
- - рубцующийся или организующийся (острый) инфаркт миокарда - трансмуральный или преимущественно субэндокардиальный некроз с преобладанием процессов резорбции и организации (давность от 3 до 8 недель).
- - повторный инфаркт миокарда - свежий инфаркт при наличии рубца от ранее перенесенного инфаркта.
- - смерть от хронической, либо острой аритмии возникшей как осложнение аритмогенных факторов на фоне ХИБС.
При верификации и вынесения диагноза следует учитывать наличие всех морфологических признаков нарушения кровотока в магистральных артериях сердца, нарушения микроциркуляции и проницаемости сосудистых стенок, структурно-функциональное состояние мышечной ткани и изменения стромы.
При необходимости дифференциальной диагностики ХИБС и алкогольной кардиомиопатии (АКМП) следует пользоваться следующими признаками.
Дифференциальная диагностика ХИБС и АКМП
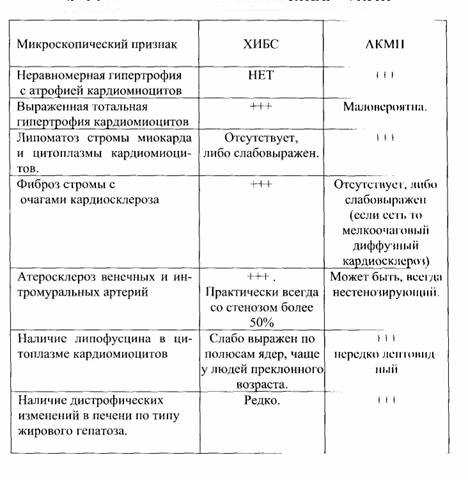
ВОЗМОЖНЫЕ ОСЛОЖНЕНИЯ И СПОСОБЫ ИХ УСТРАНЕНИЯ
Не выявлены.
ЭФФЕКТИВНОСТЬ ИСПОЛЬЗОВАНИЯ МЕТОДА
В ходе разработки метода использованы результаты вскрытия, качественного, полуколичественного и количественного судебно-гистологического исследования более 350 трупов лиц с известными причинами смерти из обозначенных групп. При сопоставлении результатов анализа с клинико-анамнестическими данными достигнуто удовлетворительное сходство.
До разработки данного метода не было возможности научно обосновать возможность применения танатогенетического анализа для установления причины смерти.
Таким образом, метод не имеет аналогов.
Для испытания разработанного метода использовано 345 наблюдений из экспертной практики, где ставились вопросы о причине смерти. Во всех наблюдениях применение метода дало возможность научно обоснованно ответить на эти вопросы. Эти данные подтверждают практическую значимость разработанного метода. Достоинства метода состоят также в том, что он, являясь достаточно информативным, не требует ни применения дорогостоящей техники и расходных материалов, ни длительного обучения экспертов и больших затрат их рабочего времени.
Учитывая возможность более быстрого и продуктивного способа диагностики, происходит экономия как рабочего времени, так уменьшение не всегда оправданной эксплуатации дорогостоящего оборудования.
похожие статьи
Структура экспертной работы по исследованию трупов на примере Шегарского межрайонного отделения ОГУЗ БСМЭТО за 2016–2017 годы / Зеленцова А.П., Качаева А.А., Сапега А.С., Степанова В.С., Сергеев А.П. // Избранные вопросы судебно-медицинской экспертизы. — Хабаровск, 2018. — №17. — С. 76-77.