Получение сывороток анти-P иммунизацией животных эхинококковым аллергеном
/ Мишакова М.В. // Судебно-медицинская экспертиза. — М., 1963 — №4. — С. 34-37.

Научно-исследовательский институт судебной медицины (дир. — проф. В.И. Прозоровский) Министерства здравоохранения СССР
Поступила в редакцию 5/V 1963 г.
Агглютиноген Р может быть обнаружен нормальной или изоиммун- еой сывороткой человека, нормальными сыворотками свиньи, лошади и рогатого скота и гетероиммунными сыворотками, полученными в результате иммунизации кроликов и морских свинок эритроцитами человека, содержащими фактор Р [Л.К. Аржелас, Е.С. Лутчева, М.Н. Резникова, М.И. Потапов и Н.А. Соловьева, С.Е. Гуревич, М.В. Мишакова, Кра и Хартер (Krah и Harter), Андрезен (Andresen), Юнгмихель (Jungmichel), Ландштейнер и Левин (Landsteiner и Levine) и др.]. Однако очень трудно получить сыворотки анти-Р высокого титра. В 1958 г. мы изготовили иммунные сыворотки анти-Р путём иммунизации кроликов эритроцитами человека (Судебномедицинская экспертиза, 1960, № 1.). Налажено регулярное производство этих сывороток с титром 1:32—1:128. В 1957 г. Кемерон и Стэвли (Сагпетоп и Staveley) высказали предположение, что в жидкости эхинококковых пузырей содержится P-субстанция, так как у пациентов, больных эхинококкозом, в сыворотке содержатся антитела анти-Р. В 1958 г. Прокоп и Эстерли (Prokop и Oesterle) пытались иммунизировать жидкостью из эхинококковых пузырей свиной печени кроликов, морских свинок, крыс, собак и свиней, однако примененная жидкость оказалась неантигенной. В 1960 г. Керде, Фюнфхаузен, Брунк и Брунк (Kerde, Ftinfhausen, Re Brunk и Ru Brunk) получили иммунные сыворотки анти-Р с титром 1:256—1:512, иммунизируя коз жидкостью эхинококковых пузырей, причем все 6 коз выработали антитела анти-Р.
Принимая во внимание эти данные, а также то, что от коз можно получить больше крови, чем от кроликов, мы поставили перед собой задачу получить иммунные сыворотки анти-Р иммунизацией козы эхинококковым антигеном. Кроме того, провели такую же иммунизацию кроликов.
Мы употребляли готовый эхинококковый аллерген, применяемый для постановки диагностической внутрикожной пробы. Аллерген предварительно проверили на наличие субстанции Р. Для этого его разводили в 10, 20, 40, 80, 160 раз физиологическим раствором. К 0,2 мл неразведенного и разведенного аллергена добавляли 0,2 мл иммунной кроличьей сыворотки анти-Р с титром 1 :64. Для контроля 0,2 мл этой сыворотки смешивали с 0,2 мл физиологического раствора. После добавления 2% взвеси эритроцитов смесь оставляли на один час при комнатной температуре, центрифугировали в течение одной минуты при 1500 об/мин, пробирки встряхивали и результат учитывали невооруженным глазом и под микроскопом (см. таблицу).
Проверка эхинококкового аллергена в реакции задержки агглютинации на наличие в нем субстанции Р
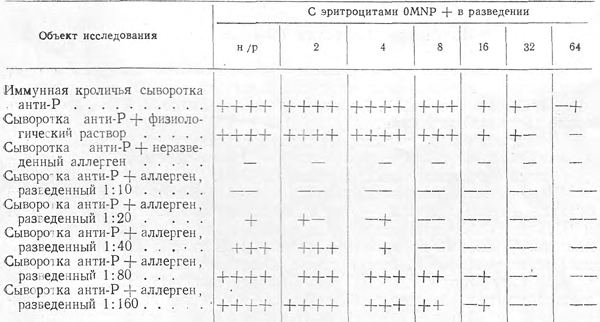
Обозначения: + + + + реакция агглютинации, видимая макроскопически; + + + реакция агглютинации, видимая в лупу; + + крупные конгломераты склеившихся эритроцитов, видимые под микроскопом; + более мелкие конгломераты на фоне несклеившихся эритроцитов, видимые под микроскопом; + — слабо выраженная агглютинация, видимая под микроскопом;- + отдельные очень мелкие конгломераты, состоящие из 3—4 эритроцитов, видимые под микроскопом; н/р неразведенная сыворотка.
Как видно из таблицы, аллерген содержит субстанцию Р, которая в разведении 1 :40 задерживает еще реакцию агглютинации с иммунной сывороткой анти-Р с титром 1:64.
Получение сывороток иммунизацией кроликов
Брали 5 кроликов породы шиншилла весом 2,4—2,6 кг. Каждому кролику вводили внутривенно 1 мл проверенного неразведенного эхинококкового аллергена в течение 6 дней подряд. Наличие антител анти-Р в сыворотках определяли на 7-й день после последней инъекции антигена. Для этого инактивированную сыворотку каждого кролика разводили физиологическим раствором в 2, 4, 5, 8 и 10 раз и абсорбировали, добавляя к неразведенной сыворотке один объем, к сыворотке, разведенной в 2 раза, — 1 /2 объема, разведенной в 4—5 раз 1/4 объема, в 8—10 раз — 1 /8 объема P-отрицательных эритроцитов, группы 0MN. Проверяли ранее описанным методом.
У одного кролика выработались агглютинины анти-Р, причем наиболее сильные сыворотки удалось изготовить после абсорбции неразведенной и разведенной в 2 раза исходной сыворотки. Полученные сыворотки анти-Р оказались неспецифичными — они агглютинировали эри- троциты групп А, В и немного 0MN, поэтому необходимо было освободить их от антител анти-А, анти-В и анти-0. Для такой окончательной абсорбции применяли кровь групп А, В и 0 типа MN, не содержащих фактора Р. Добавляли Vs объема эритроцитов группы 0 и по 74 объема групп А и В.
В результате были получены 2 специфичные сыворотки, одна из которых, приготовленная из неразведенной исходной сыворотки, имела титр антител анти-Р 1:32, другая из той же исходной сыворотки, разведенной в 2 раза, — титр 1:8.
Таким образом, от 1 из 5 иммунизированных кроликов были получены сыворотки анти-Р с титром 1:8—1:32. Однако, несмотря на такой титр, степень выраженности агглютинации была меньше, чем у сывороток, полученных в результате иммунизации кроликов эритроцитами 1.
Получение сывороток иммунизацией козы
Иммунизировали проверенным эхинококковым аллергеном одну козу путем 5 внутривенных инъекций 5 мл антигена с трехдневными интервалами между ними. Кровопускание следовало на 8-й и 10-й день после последней инъекции.
Инактивированную сыворотку, неразведенную и разведенную в 2 раза, абсорбировали в первом случае одним объемом, во втором — 7 г объема P-отрицательных эритроцитов OMN.
В результате у козы образовались антитела анти-Р, но сыворотка оказалась неспецифичной — она агглютинировала эритроциты групп А и В. Для освобождения от антител анти-А и анти-В к сыворотке добавляли по 1 /4 объема эритроцитов групп А и В типа MN, не содержащих агглютиногена Р. После такой абсорбции была получена специфичная сыворотка с титром 1:32. Пытаясь получить сыворотку более высокого титра, козе через 45 дней после последней инъекции дополнительно производили 6 внутривенных инъекций по 5 мл эхинококкового аллергена с трехдневными интервалами между инъекциями. Однако титр сыворотки был прежним — 1:32.
Таким образом, полученные кроличьи и козьи сыворотки имели титр несколько ниже, чем при иммунизации кроликов эритроцитами. Кроме того, способность агглютининов этих сывороток соединяться с агглютиногеном Р эритроцитов меньше, чем у сывороток, полученных в результате иммунизации кроликов эритроцитами. Так, ни козья, ни кроличья сыворотки не вызывали агглютинацию, видимую невооруженным глазом, несмотря на то что титр их был 1:32.
Возможно, что при иммунизации животных жидкостью, взятой непосредственно из эхинококковых пузырей, можно получить сыворотки анти-Р более активные и более высокого титра.
Далее следует отметить, что при наличии небольшой активности и невысокого титра полученных козьих иммунных сывороток анти-Р изготовление таковых не является более экономичным для производства, так как эти сыворотки можно изготовить лишь из неразведенной неабсорбированной сыворотки или разведенной в 2 раза. В то же время сыворотки с таким и более высоким титром можно изготовить из неабсорбированных кроличьих сывороток, полученных в результате иммунизации кроликов P-положительными эритроцитами при разведении их в 15, 30 и 40 раз. В ходе изготовления 95 серий иммунных сывороток анти-Р мы ни разу не сталкивались с тем, чтобы из неабсорбированных сывороток, полученных в результате иммунизации кроликов Р-положительными эритроцитами человека, можно было изготовить специфичную сыворотку анти-Р только при разведении их 1:2 или из неразведенных нативных сывороток.
Выводы
- Готовый эхинококковый аллерген вызывает выработку антител анти-Р как у коз, так и у кроликов.
- Сыворотки анти-Р, полученные в результате иммунизации этим аллергеном, менее активны в реакции агглютинации, чем сыворотки, полученные от кроликов, иммунизированных P-положительными эритроцитами.
похожие статьи
Определение групповой принадлежности изолированных клеток влагалищного эпителия / Локтева Р.В., Локтев А.И., Шишкина Ж.А., Курзин Л.М. // Избранные вопросы судебно-медицинской экспертизы. — Хабаровск, 2022. — №21. — С. 78-82.
Использование методики окрашивания препаратов раствором акридинового оранжевого при определении групповой принадлежности изолированных клеток с помощью реакции смешанной агглютинации / Локтева Р.В., Королева М.В., Панасенко С.В., Курзин Л.М. // Избранные вопросы судебно-медицинской экспертизы. — Хабаровск, 2022. — №21. — С. 73-78.
Метод избирательной абсорбции при определении кровяных групп в кровяных пятнах / Серебряников П. // Судебно-медицинская экспертиза. — М.: Изд-во Наркомздрава, 1928. — №8. — С. 3-7.
Судебно-медицинские экспертизы и исследования вещественных доказательств биологического происхождения в России (по материалам 2003—2017 гг.) / Ковалев А.В., Куприна Т.А., Самоходская О.В., Кондратова И.В. // Судебно-медицинская экспертиза. — М., 2018. — №6. — С. 29-32.
Обнаружение эклипсных антигенов в трупной крови / Локтева Р.В. // Избранные вопросы судебно-медицинской экспертизы. — Хабаровск, 2019. — №18. — С. 127-131.