О сохраняемости производных барбитуровой кислоты в печени трупа
/ Швайкова М.Д., Изотов Б.Н., Кокшарова Н.В., Метелева Е.В., Хомов Ю.А. // Судебно-медицинская экспертиза. — М., 1974 — №4. — С. 33-36.

УДК 340.67:616.36-099:547.854.51-079.6
Кафедра токсикологической химии (зав. — проф. М.Д. Швайкова) I Московского медицинского института
Производные барбитуровой кислоты хорошо сохраняются и могут быть надежно идентифицированы и определены в загнившем материале, хранившемся от 1 до 6 мес. Таблиц 3. Иллюстрация 1.
A STUDY ON THE CONSERVATION OF BARBITURIC DERIVATIVES IN THE CADAVERIC LIVER
M. D. Shyaikova, B. N. Izotov, N. V. Koksharova, E. V. Meteleva, Y. A. Komov
A possibility of reliable identification and estimation of various barbituric derivatives in decomposed material dating up to 6 months is demonstrated.
В практике судебно-химических экспертиз нередки случаи исследования загнившего биологического материала. Наше сообщение касается сохраняемости производных барбитуровой кислоты в трупе человека, а также влияния продуктов гнилостного разложения на их обнаружение и определение при различных сроках хранения.
Ряд авторов (А.И. Костякова; Н.А. Горбачева и А.Ф. Рубцов; Algeri, и др.) отмечали, что барбитураты достаточно хорошо сохраняются в трупном материале. Однако при анализе загнившего биологического материала Jackson и Finkle обнаружили вещества, получившие название «псевдобарбитураты», которые обладают способностью поглощать в той же области спектра, что и барбитураты, создавая помехи при спектрофотометрическом определении. «Псевдобарбитураты» найдены в печени, почках, мышцах, крови, моче (Nickolls; Umberger, и др.). Для отделения барбитуратов от сопровождающих компонентов чаще всего используют хроматографию в тонком слое сорбента.
Возможность определения барбитуратов при сроках хранения биологического материала от 1 до 6 мес мы установили на примере наиболее употребительных соединений: барбитала, фенобарбитала, барбамила этаминал-натрия. Объектом исследования выбрали печень.
Методика. Печень измельчали. К 100 г средней пробы прибавляли 40 мг барбитурата в водном растворе и оставляли в колбах с резиновыми пробками в теплом, проветриваемом помещении при 18—25° сроком на 1 и 6 мес. Одновременно ставили контрольные опыты (печень без барбитуратов). Объекты исследовали параллельно с пробами, содержащими барбитурат. По истечении указанного времени объект заливали 200 мл дистиллированной воды, подкисленной водным раствором щавелевой кислоты до рН 200 по универсальному индикатору и при частом перемешивании настаивали при комнатной температуре, затем переносили в стакан для центрифугирования емкостью 500 мл и центрифугировали 30 мин. при 3,5 тыс. об/мин. Центрифугат процеживали через ватный тампон, смоченный дистиллированной водой, в делительную воронку и экстрагировали при рН 2,0 хлороформом (20, 15, 15 мл) каждый раз по 5 мин. Образующуюся эмульсию разрушали центрифугированием (4,5—5 тыс. об/мин, 5 мин). После разделения фаз хлороформное извлечение, содержащее барбитурат, реэкстрагировали 0,1 н. раствором едкого натрия (1 часть на 2 части органической фазы) 5 мин. После центрифугирования водную фазу отсасывали пипеткой, подкисляли соляной кислотой до рН 2,0 и дважды экстрагировали хлороформом по 20 мл (по 5 мин). Хлороформные вытяжки объединяли и доводили хлороформом до 50 мл.
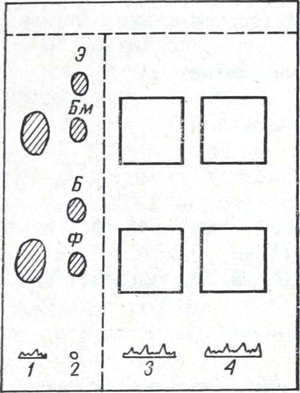
Хроматограмма барбитуратов, выделенных
из биологического материала.
Ф — фенобарбитал; Б — барбитал;
Бм — барбамил; Э — этаминал-натрия;
1, 2 — зоны барбитуратов в исследуемом
извлечении, 3, 4 — элюируемые участки
сорбента, соответствующие обнаруженным
барбитуратам.
2 мл хлороформного извлечения испаряли под струей теплого воздуха примерно до 0,1 мл и количественно наносили на стартовую линию хроматографической пластинки с закрепленным слоем силикагеля КСК1 (см. рисунок). На расстоянии 1 см от первой точки на вторую наносили последовательно по 0,02 мл (20 мкг) метаноловых растворов барбитала, фенобарбитала, барбамила и этаминал-натрия. В точки 3 и 4 наносили в виде полосы длиной около 1—1,5 см соответственно 10 мл (1/5 части) и 2,5—10 мл (1/20—1/5 части) хлороформного извлечения, предварительно упаренного до 0,1—0,2 мл. Все операции проводили количественно, несколько раз смывая остаток хлороформом. Хроматографировали 45 мин в камере, предварительно (20 мин) насыщенной парами растворителя в системе хлороформ — н-бутанол — 25% раствор аммиака (70:40:5). Длина пробега растворителя 10 см. После подсушивания до полного удаления органических растворителей часть пластинки в зонах хроматографирования точек 1 и 2 опрыскивали 0,02% раствором дифеншгкарбазона в хлороформе и водным раствором сульфата ртути2. В местах расположения барбитуратов наблюдались синие или красно-фиолетовые пятна, контуры их отмечали и вычисляли Rf (барбитал 0,52—0,57, фенобарбитал 0,40—0,42, барбамил 0,75, этаминал 0,78). Параллельно обнаруженным пятнам прибором для вакуум-экстракции (Richelmann) снимали со второй половины пластинки зоны сорбента (2×2 см) и элюировали из точки 3—5 мл смеси эфира и этанола (1:1), а из точки 4—боратным буфером рН 10,0 дважды по 10 мл. Элюировали под вакуумом со стекляннным фильтром № 4.
В спирто-эфирном элюате барбитураты выявляли микрокристаллическими реакциями выделения кислотной формы и получения йодидных комплексов.
Порции водного элюата объединяли и доводили боратным буфером в мерной колбе до 25 мл (при D>1 разводили). Спектрофотометрировали в области 220—300 нм, получая характерные для барбитуратов спектры с максимумами в области 238—240 нм. Для количественного определения измеряли разность оптических плотностей при 239 нм в щелочном (рН 10,0) и кислом (рН 2,0: его создавали добавлением в кювету 1 капли концентрированной соляной кислоты) растворах, в 1 см кварцевой кювете на спектрофотометре СФ-4А. Концентрацию рассчитывали по уравнению закона Бера.
D = E1%1 см × 1 × с
Таблица 1
Результаты определения барбитуратов (в %) в трупе (среднее из 5 определений)
| Барбитурат | Срок хранения | |
| 1 мес | 6 мес | |
| Барбитал | 1,89±0,29 | 2,84±0,36 |
| Фенобарбитал | 14,27 ±2,84 | 14,98±0,72 |
| Барбамил | 23,04±2,95 | 21,22±1,35 |
| Этаминал-натрий | 21,01±2,03 | 20,08±0,51 |
Примечание. Опыты с барбитуратами, добавленными к печени, хранившейся до 1 нед, дали следующие результаты: барбитал — 2,79±0,33: фенобарбитал—13,22±1,52; барбамил — 23,92±2,43; этаминал-натрий — 24,82± ±0,87.
Удельные показатели поглощения E1%1 см определяли заранее, измеряя оптическую (плотность растворов барбитуратов в боратном буфере с известной концентрацией (от 2 до 20 мкг/мл) при указанных значениях рН и длине волны. С учетом разведения в буфере и взятой для определения аликвоты хлороформного извлечения рассчитывали количество изолированного барбитурата.
Таблица 2
Абсорбция при 239 нм посторонних примесей, экстрагируемых совместно с барбитуратами из гнилостного материала
| Зона барбитурата | Срок хранения | |||||
| 1 мес | 6 мес | |||||
| DpH 10,0 | DpH 2,0 | D диф. | DpH 10,0 | DpH 2,0 | Вдиф. | |
| Барбитал | 0,011 | 0,011 | 0 | 0,002 | 0,002 | 0 |
| Фенобарбитал | 0,028 | 0,028 | 0 | 0,007 | 0,008 | 0,001 |
| Барбамил | 0,007 | 0,007 | 0 | 0,015 | 0,015 | 0 |
| Этаминал | 0,007 | 0,007 | 0 | 0,015 | 0,015 | 0 |
Примечание. Опыты с барбитуратами, добавленными к печени, хранившейся до 1 нед, дали следующие результаты: барбитал — 2,79±0,33: фенобарбитал—13,22±1,52; барбамил — 23,92±2,43; этаминал-натрий — 24,82± ±0,87.
Изолирование подкисленной водой с последующей экстракционной и хроматографической очисткой дало возможность надежно идентифицировать и определять барбитураты в биологическом материале, хранившемся от 1 до 6 мес. Во всех опытах получили характерные для того или иного барбитурата Rf микрокристаллические реакции и спектральные характеристики в УФ-области. Данные количественного определения представлены в табл. 1.
Основным критерием возможности применения дифференциального спектрофотометрического определения барбитуратов, изолированных из биологического материала, является равенство абсорбции мешающих веществ в кислом (рН 2,0) и щелочном (рН 10,0) растворах при 239 нм. В этом случае посторонняя абсорбция математически уничтожается, если в уравнение закона Бэра вместо D подставить разницу в абсорбции элюатов при указанных значениях рН. Мы предварительно измеряли дифференциальную абсорбцию элюатов холостых проб биологического материала со сроком хранения 1 и 6 мес. Сочетание экстракционной и хроматографической очистки позволило полностью исключить поглощение посторонних примесей (табл. 2).
Из этих данных видно, что дифференциальная абсорбция посторонних примесей при работе с печенью практически равна нулю, что дает возможность надежно определять барбитураты спектрофотометрическим методом.
Таблица 3
Абсорбция при 239 нм посторонних примесей, экстрагируемых подкисленным спиртом из гнилостного материала
| Зона барбитурата | Срок хранения 6 мес | ||
| DpH 10.0 | DpH 2.0 | Dдиф. | |
| Барбитал | 0,079 | 0,042 | 0,037 |
| Фенобарбитал | 0,074 | 0,046 | 0,028 |
| Барбамил | 0,127 | 0,083 | 0,044 |
| Этаминал | 0,127 | 0,083 | 0,044 |
Попытка изолировать барбитураты из биологического материала со сроком хранения 6 мес подкисленным спиртом с последующей экстракционной и хроматографической очисткой привела к неудовлетворительным результатам.
Поглощение холостых проб было высоким и неодинаковым при различных значениях рН (10,0 и 2,0) (табл. 3), что исключало возможность спектрофотометрического определения.
Выводы
- Предложена методика определения барбитуратов (барбитала, фенобарбитала, барбамила, этаминала) в загнившей печени с использованием извлечения подкисленной водой, последующей экстракционной и хроматографической очисткой, микрокристаллоскопией и дифференциальной спектрофотометрией в УФ-области.
- Барбитураты хорошо сохраняются, их можно надежно идентифицировать и определять в биологическом материале со сроками хранения от 1 до 6 мес.
1 На пластинки размером 9X12 см наносили смесь: 2,8 г силикагеля КСК (150— 200 меш), 0,17 г гипса и 7,5 мл 0,1 н. раствора борной кислоты, сушили при комнатной температуре на строго горизонтальной поверхности в течение суток.
2 Раствор сульфата ртути: 5,0 г HgO растворяют в 100 мл дистиллированной воды и 10 мл концентрированной серной кислоты и доводят до 250 мл.
похожие статьи
Особенности распределения 2,4- и 2,6-ди-трет-бутилгидроксибензола в организме теплокровных животных / Шорманов В.К., Цацуа Е.П., Асташкина А.П. // Судебно-медицинская экспертиза. — М., 2019. — №1. — С. 36-42.