Комбинированное отравление фенитоином, фенобарбиталом и сибазоном (Случай из практики)
/ Галкина В.С., Крупина Н.А., Краснова Р.Р., Пашовкина Р.Н. // Мат. VI Всеросс. съезда судебных медиков. — М.-Тюмень, 2005.

(Московская область)
На исследование в судебно-химический отдел (СХО) поступили биообъекты от трупа мужчины, Ч, г.р. 1987.
Краткие обстоятельства дела: «Скоропостижно скончался. Двусторойняя пневмония»
Вопросы, подлежащие разрешению при судебно-химическом исследовании: наличие алкоголя, наркотических и снотворных веществ.
Результаты проведенного предварительного исследования представлены в таблице:
Таблица 1
Используемые методы | биообъекты, поступившие на исследование | |
моча | кровь | |
ГХ-ДТ этиловый спирт | отр. | отр. |
ИФА скрининг на опиаты | отр. | |
ПФИА скрининг |
| |
ГХ-МС скрининг | фенитоин, | фенитоин, |
В практических лабораториях России наиболее распространенным методом определения лекарственных веществ является тонкослойная хроматография (ТСХ) в сочетании с подтверждающими методами анализа, поэтому использование подтверждающих методов анализа позволит повысить надежность и чувствительность этого анализа. Среди подтверждающих методов анализа в настоящее время используем газожидкостную хроматографию (ГЖХ), высокоэффективную жидкостную хроматографию (ВЭЖХ), хроматомасс-спектрометрию (ХМС).
Приготовление растворов
Стандартные субстанции тестовых веществ готовили в концентрации 1 мг/мл в этаноле. Калибровочные образцы содержали следующие концентрации фенобарбитала от 5 мг/л до 50 мг/л. Калибровочные образцы содержали следующие концентрации фенитоина от 10 мг/л до 100 мг/л. Внутренний стандарт 5-(4 –метил – фенил-5 – фенилгидантоин) – МРРН с концентрацией 10 мкг/мл.
Подготовка проб
А. Экстракция веществ кислого и нейтрального характера.
Методика исследования: 10 г тканей печени (и почки) гомогенизировали в 40 мл дистиллированной воды, с помощью Блендера. Получили разведение 1:5. К 10 мл полученного гемогенизата добавили 300 мкл 10% раствора серной кислоты до рН 3 (контроль рН-метр) и 5 г хлорида натрия, настаивали 2 часа при комнатной температуре на аппарате для встряхивания. Смесь центрифугировали в течение 30 минут при 3000 об/мин. Надосадочную жидкость слили, установили рН 3 (контроль рН-метр).
Водное извлечение экстрагировали 12 мл диэтилового эфира в течение 30 минут, затем центрифугировали в течение 5 минут при 4000об/мин. Эфирный экстракт перенесли в пробирку, вместимостью 10 мл. Эфир испарили в концентраторе в потоке воздуха, при температуре 50˚ С досуха. К остатку в пробирке добавили 150 мкл ацетонитрила, встряхивали в течении 5 минут на вибрационном смешивателе СВ- 1 Вортекс, режим 5-6, добавили 3 мл н-гексана, встряхивали пробирку в течение 30 секунд на Вортексе и центрифугировали в течение 10 минут при 4000 об/мин. Верхний слой отделили и не исследовали, а органический слой перенесли в полиэтиленовую пробирку с пробочкой и исследовали (экстракт I).
Б. Экстракция веществ нейтрального и основного характера.
К водной фазе, оставшейся после экстракции эфиром, добавили 170 мкл 25% раствора гидроксида аммония, рН9-10 (контроль рН-метр). Затем добавили 15 мл дихлорметана, экстрагировали 30 минут, центрифугировали в течение 5 минут при 4000об/мин. Верхнюю водную фазу с помощью водоструйного насоса отбросили, а органическую фазу выпарили не досуха в концентраторе (порциями по 5 мл) в потоке воздуха, около 30 минут, при 50˚ С. К остатку (не сухому) около 200 мкл, добавили 170 мкл смеси метанол – ацетонитрил – 1м раствор соляной кислоты (35:35:30) и встряхивали на вибрационном многогнездном смешивателе СВ- 1 Вортекс, режим 5-6, в течение 2 минут. Экстракт из пробирки полностью перенесли пипеткой с удлиненным наконечником в узкую Эппендорфовскую пробирку вместимостью 0,5 мл. Центрифугировали течение 2 минут при 9000 об/мин. Верхний слой наносили по 10 мкл в виде пятен (диаметр пятна не более 3 мм) на ТСХ пластины (экстракт II).
Анализ экстрактов I и II
Тонкослойная хроматография.
Полученные экстракты I и II исследовали методом ТСХ, используя при этом пластины «Сорбфил», изготовленные стандартным методом с фиксированным слоем силикагеля СТХ – 1А, зернение 5-17 мкм, толщина слоя 110 мкм, тип подложки ПЭТФ, размер пластин 100-150 мм.
Системы растворителей для веществ кислого и нейтрального характера (экстракт I)
- А. хлороформ – н- бутанол – 25% раствор гидроксида аммония (70:40:5). Проявление – 0,02% раствор ДФК и 2% раствор сульфата окисной ртути.
- В. хлороформ – ацетон (4:1). Проявление – 10% раствор хлорида окисного железа, реактив Драгендорфа в модификации по Мунье и 20% раствор серной кислоты.
- С. хлороформ – ацетон (4:1). Проявление – тетраметилбензидиновым реактивом (ТМБ).
Системы растворителей для веществ нейтрального и основного характера (экстракт II)
- D. ацетон – толуол - этанол 96˚ - 25% раствор гидроксида аммония (45:45:4:3). Проявление - 10% раствор хлорида окисного железа, 50% раствор серной кислоты и этанола 96˚ (1:1) и реактив Драгендорфа в модификации по Мунье.
- Е. толуол – ацетон – 25% раствор гидроксида аммония (50:50:1). Проявление – реактив Драгендорфа в модификации по Мунье и 20% раствор серной кислоты.
- F. этилацетат – метанол – 25% раствор гидроксида аммония (85:10:5). Проявление – реактив Марки.
- G. бензол – диоксан – 25% раствор гидроксида аммония (60:35:5). Проявление – концентрированная серная кислота.
Таблица2
Результаты проведенного ТСХ исследования экстрактов:I - рН 3, II – рН 9-10
| Исследуемые объекты | Системы/проявитель | ||||||
В-ва кислого и нейтрального характера | В-ва нейтрального и основного характера | ||||||
IA | IB | IC | IID | IIE | IIF | IIG | |
ДФК+ | FeCl3+ | ТМБ | FeCl3+ | р-в Драг+ | р-в | H2SO4 | |
Печень | Фенобарбитал | Оксазепам | Фенобарбитал | отрц. | отрц. | отрц. | отрц. |
Почка | Фенобарбитал | Оксазепам | Фенобарбитал | отрц. | отрц. | отрц. | отрц. |
Скрининг лекарственных веществ нейтрального и основного характера в моче и крови методом хромато-масс-спектрометрии (ХМС).
Метод скрининга лекарственных веществ в моче и крови основывается на жидкость жидкостной экстракции с последующим использованием дериватизирующего реагента N,O-бис триметилсилил)-трифлуороацетамид +1% триметилхлорсилан БСТФА + 1% ТМС /силилирующий реагент/ для улучшения хроматографических свойств многих лекарственных соединений и их метаболитов, в том числе фенитоина.
В качестве объектов исследования ислользовали цельную кровь и мочу. В качестве контроля отрицательного - бланковые плазму и мочу (не содержащую лекарственных веществ).
1. В стеклянные пробирки внесли по 1 мл крови (I) и 1 мл мочи (II). Добавили по 50 мкл раствора ДФА в метаноле 20 мг/л (внутренний стандарт), 0,3мл 1М раствора трис-гидроксиметил-аминометана (трис-буфер) (рН 11). Встряхнули. Образцы экстрагировали 300 мкл бутилацета, интенсивно встряхивая 2 минуты на вибрационном встряхивателе. Центрифугировали 5 минут при 4000об/мин. По 250 мкл органической фазы перенесли в виалы. Экстракты испарили под током инертного газа. Во флаконы с сухим остатком (I) и (II) с помощью шприца внесли по 100 мкл реактива БСТФА +1%ТМС, флаконы герметично закрыли, тщательно встряхнули, нагрели в термостате 20 минут при 50°С.
2. В стеклянный контейнер с завинчивающейся крышкой внесли 3 мл мочи (III), добавили 0,3мл концентрированной соляной кислоты, герметично закрыли и выдержали в течение 15 минут в кипящей водяной бане. После охлаждения гидролизат довели боратным буфером до pH9 (по универсальному индикатору) и экстрагировали 10 мл смеси хлороформ-изобутанол в соотношении 9:1. Затем смесь центрифугировали в течение 10 мин. при 3000 об/мин. Водный слой удалили с помощью водоструйного насоса. Органический слой профильтровали через безводный сульфат натрия (2,5г). Фильтр промыли 2 мл смеси хлороформ-изобутанол. Фильтрат присоединили к основному экстракту. Объединённый экстракт выпарили при комнатной температуре досуха и исследовали методом хромато-масс-спектрометрии. Сухой остаток (III) гидролизного извлечения перенесли с помощью 0,5 мл метанола в виалу. Экстракт испарили под током инертного газа. Во флакон с сухим остатком внесли 100 мкл реактива БСТФА +1%ТМС, флакон герметично закрыли и тщательно встряхнули, нагрели в термостате 20 минут при 50°С.
Исследование проводилось на газовом хроматографе Agilent Technologies 6890N и масс-селективным детектором Agilent Technologies 5973N в режиме сканирования индивидуальных ионов: Колонка хроматографа кварцевая, капиллярная HP-5ms (30 м х 0,25 мм х 0,25нм). Начальная температура колонки-700С. Время выдержки при начальной температуре-1 минута. Подъем температуры в диапазоне 70-2800С-200С/мин. Скорость газа носителя (гелий)-1 мл/мин. Температуры инжектора, источника и квадруполя-2800С, 2300С и 1500С соответственно. Объем вводимой пробы-1 мкл. Диапазон масс-39-500 а.е.м.
Идентификация наблюдаемых на хроматограммах пиков проводилась по масс-спектрам электронного удара, ионным масс-хроматограммам и библиотекам масс-спектров: PMW_TOX3.L и NIST02.L.
Результаты исследования:
- I. В крови обнаружены: фенитоин в виде фенитоин 2ТМС производного, метаболит фенитоина – гидроксифенитоин в виде гидроксифенитоин 3 ТМС производного и фенобарбитал в виде фенобарбитал 2 ТМС производного.
- II. В моче обнаружены: фенитоин в виде фенитоин 2ТМС производного, оксазепам в виде оксазепам 2ТМС.
- III. В гидролизованной моче обнаружены: фенитоин в виде фенитоин 2ТМС производного, метаболит фенитоина – гидроксифенитоин в виде гидроксифенитоин 3 ТМС производного и фенобарбитал в виде фенобарбитал 2 ТМС производного, оксазепам в виде оксазепам 2ТМС.
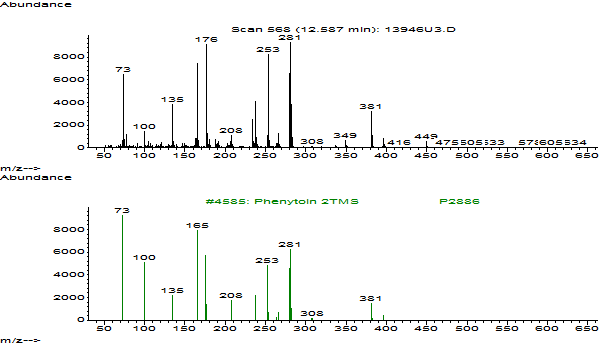
Рис. 1 Масс-спектры силилированного производного фенитоина (фенитоин 2ТМС) (извлечение из гидролизованной мочи (3 мл) и стандарт)
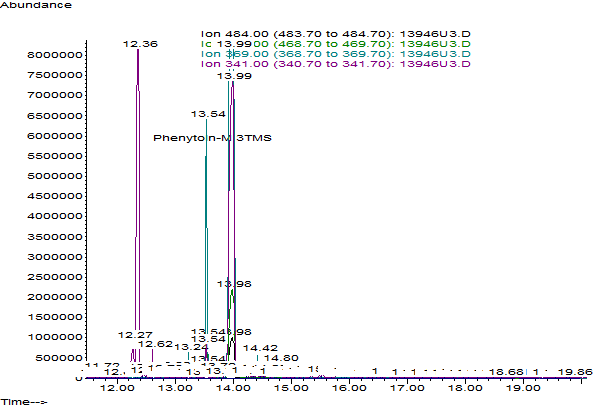
Рис. 2 Фрагмент хроматограммы силилированного извлечения гидролизованного образца мочи (3 мл) с экстракцией по характеристическим ионам (метаболит фенитоина – гидроксифенитоин в виде гидроксифенитоин 3 ТМС производного)

Рис.3 Масс-спектр метаболита фенитоина – гидроксифенитоина в виде гидроксифенитоин 3 ТМС производного

Рис.4 Фрагмент хроматограммы силилированного извлечения гидролизованного образца мочи (3 мл) с экстракцией по характеристическим ионам (оксазепам в виде оксазепам 2ТМС производного)
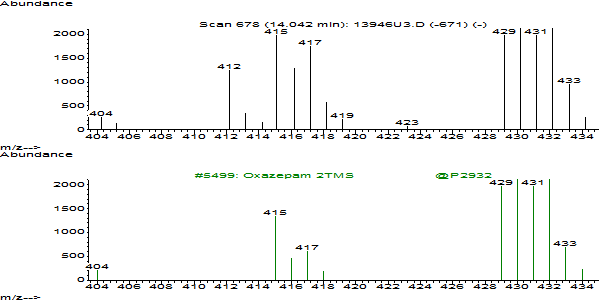
Рис.5 Масс-спектры силилированного производного оксазепама (оксазепам ТМС) (извлечение из гидролизованной мочи и стандарт)
Рис.6 Фрагмент хроматограммы силилированного извлечения из 1 мл крови с экстракцией по характеристическим ионам (фенобрбитал в виде фенобарбитал 2ТМС производного)

Рис.7 Масс-спектры силилированного производного фенобарбитала (фенобарбитал 2ТМС) (извлечение из 1 мл крови и стандарт)
Фенитоин (дифенин) белый кристаллический порошок, практически не растворим в воде, слегка растворим в спирте, в хлороформе 1:500, в эфире 1:600, хорошо растворим в 1% растворах едких щелочей.
Фенитоин– противосудорожное средство, производное гидантоина, близкого по действию к барбитуровой кислоте. Оказывает противосудорожное действие без выраженного снотворного действия. Как и другие противосудорожные средства, производные гидантоина, фенитоин оказывает возбуждающее действие на мозжечок, активируя тормозные пути, распространяющееся на кору головного мозга. Повышает болевой порог при невралгии тройничного нерва и сокращает продолжительность приступа, уменьшая возбуждение и формирование повторных разрядов.
Фенитоин применяют при лечении эпилепсии, главным образом, при больших судорожных припадках. При недостаточной эффективности фенитоина одновременно назначают фенобарбитал или другой противоэпилептический препарат. При лечении фенитоином возможны побочные явления: головокружение, возбуждение, повышение температуры тела, затруднение дыхания, тошнота, рвота, аллергические реакции (кожная сыпь, зуд и др.), гипотония, кома, распираторная дипрессия.
Фенитоин быстро всасывается из желудочно - кишечного тракта и метаболизируется в печени. Метаболиты выделяются с желчью и выводятся из организма почками.
Выпускается в виде таблеток, содержащих 0,117 г фенитоина и 0,032 г натрия гидрокарбоната. Действие этих таблеток соответствует действию дифенилгидантоина натрия. Период полужизни (Т1/2) в среднем 18-22 часа, но может изменяться в зависимости от введенной дозы. Связывание с белками плазмы около 90%. Менее 5% выделяется с мочой в неизмененном виде, остальное количество метаболизируется ферментами печени.
Основной метаболит (производное пара-гидроксифенитоин) не активен, выделяется желчью, а также с мочой в виде глюкуронида.
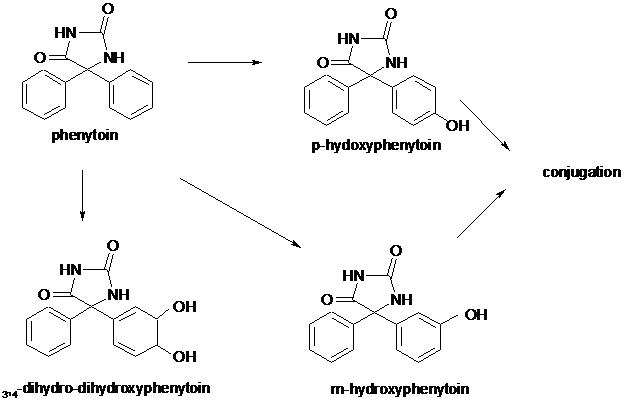
Рис. 8 Пути метаболизма фенитоина
Таким образом, после проведения скрининга лекарственных веществ в крови и моче методом ХМС, получив положительные результаты исследования, было произведено повторное исследование экстрактов II (печени и почки) на наличие фенитоина. В качестве свидетеля использовали стандартный раствор фенитоина с концентрацией 1мг/мл.
Таблица 3
Результаты проведенного ТСХ исследования экстрактов II (рН 9-10) печени и почки
Исследуемый объект | Система растворителей | ||
хлороформ-ацетон (4:1) | Этилацетат-ментанол-25%раствор гидроксида аммония (85:10:5) | этилацетат | |
Фенитоин- свидетель | 0,33 | 0,36 | 0,56 |
Почка | 0,33 | 0,36 | 0,56 |
Печень | 0,33 | 0,36 | 0,56 |
Проявитель | Реактив: 0,02% раствор дифенилкарбазона в этаноле, затем 2% раствор сульфата окисной ртути. | Тетраметилбензидиновый реактив (ТМБ) | |
Окраска пятен после проявления | Сине-фиолетовае | Желтое, переходящее в оранжево-красное | |
Затем было произведено исследование крови методом высокоэффективной жидкостной хроматографии (ВЭЖХ) для количественного определения обнаруженных лекарственных веществ.
Исследование методом высокоэффективной жидкостной хроматографии:
Исследование проводилось на жидкостном хроматографе Agilent 1100 с диодно матричным детектором (ДМД) в градиентном режиме. Колонка ZORBAХ Eсlipse XDB – C8 4,6 х 150 мм, 5 мкм. Предколонка Zorbax SB – C18, 4,6 x 12,5 мм, 5 мкм. Температура термостата колонки 300С.
- Элюент А: Вода деионизированная;
- Элюент В: Ацетонитрил ВЭЖХ Градиент
- Элюент D: Фосфатный буфер рН 3,8.
- Градиент:
Время (минуты) | % В | % D |
0 | 15 | 85 |
8 | 35 | 65 |
17 | 65 | 35 |
21 | 65 | 20 |
26 | 15 | 20 |
7- 0 | 15 | 85 |
- Скорость потока: 1 мл/мин; от 7– 0 минут кондиционирование.
- Длина волны: 220 нм.
- Объем вводимой пробы 40 мкл.
Методика исследования: 1).0,5 мл исследуемой крови (для фенитоина кровь разводили дистиллированной водой 1:1) поместили в стеклянную пробирку на 12 мл с завинчивающейся крышкой, добавили 50 мкл внутреннего стандарта 5-(4-метилфенил)–5– фенилгидантоин (MPPH) c концентрацией 10 мкг/мл, перемешали в течение 1 минуты, добавили 0,5 мл насыщенного раствора сульфата аммония, 0,5 мл аммиачного буфера рН 9,5. Экстрагировали в течение 5 минут (300 кол/мин) на аппарате для встряхивания с 5 мл смеси н – гексан – дихлорметан – изопропанол в соотношении (60:40:2). Центрифугировали 3 минуты при 4300 об/мин. Органическую фазу поместили в виалу на 4 мл и испарили при температуре 400С. Сухой остаток растворили в 100 мкл подвижной фазы (85% фосфатного буфера рН 3,8 и 15% ацетонитрила), 40 мкл ввели в ВЭЖХ.
Идентификация наблюдаемых на хроматограмме пиков осуществлялась по временам удерживания и УФ спектрам веществ. На хроматограмме наблюдали пики идентичные пикам фенобарбитала (8.969 мин), фенитоина (11.907 мин) и диазепама (15.709).
Контрольная смесь веществ: кофеин, фенобарбитал, димедрол, МРРН феназепам с концентрацией 10 мкг/мл.
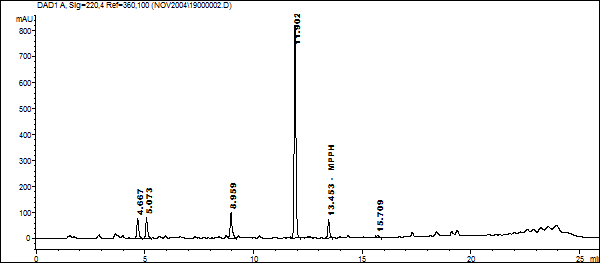
Рис.9 Хроматограмма экстракта крови (0,5мл), полученная методом ВЭЖХ с ДМД (Длина волны – 220 нм).
Количественное определение: Калибровочные растворы готовили из стандартных веществ в концентрации 1мг/мл в метаноле (для фенобарбитала и сибазона) и аммиачном буфере рН 9,5 (для фенитоина) с учетом терапевтических, токсических и летальных концентраций этих веществ в 1л крови.
Калибровочные растворы: фенобарбитала 5мг/л, 10мг/л, 20мг/л, 50мг/л; фенитоина 10мг/л, 25мг/л, 50мг/л, 100мг/л. Внутренний стандарт MPPH.
В 0,5мл бланковой плазмы добавляли по 50мкл (по 2 пробы) каждой концентрации калибровочных растворов, перемешивали, настаивали в течение 5 минут, добавляли 50мкл внутреннего стандарта (MPPH) с концентрацией 10мкг/мл. Далее экстрагировали и исследовали аналогично описанному выше.
Прибор с помощью программного обеспечения ChemStation автоматически проводит интегрирование пиков и по данным калибровочной таблицы строится калибровочный график.
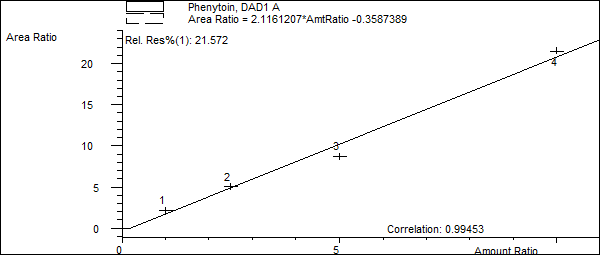
Рис.10 Калибровочный график для фенитоина.
Для определения концентрации фенобарбитала в крови использовали метод обработки PHENOB1. M
Для определения концентрации фенитоина в крови использовали метод обработки PHENYT1.M
Для определения концентрации диазепама (сибазона) использовали метод обработки Sibazon 1.М
В крови обнаружены фенобарбитал в концентрации 44,1мг/л, фенитоин в концентрации 58,98мг/л х 2 =117,96мг/л и диазепам в концентрации 0,27 мг/л.
По данным Международной Ассоциации судебных токсикологов, том 26, №1, Дополнение, 1996 год под редакцией Donald R.A. Uges, University Hospital Groningen, The Netherlands терапевтическая концентрация фенобарбитала в сыворотке составляет (10) 20 - 40 мг/л, токсическая 60 - 80 мг/л; летальная 100 - 150 мг/л. Токсическая концентрация фенитоина в сыворотке составляет 20 – 30 мг/л; летальная 100 мг/л. Терапевтическая концентрация диазепама в сыворотке составляет 0,125 – 0,75 мг/л, токсическая 1,5 – 5 мг/л.
Выводы
- При проведении ТСХ обнаружения фенитоина необходимо проводить реакцию с дифенилкарбазоном и сульфатом окисной ртути со щелочными извлечениями.
- Инструментально - хроматографические (ХМС, ВЭЖХ и др.) методы, обладающие высокой чувствительностью и специфичностью, позволяют расширить спектр определяемых веществ и провести идентификацию неизвестного лекарственного вещества.
- Определение концентрации фенитоина в крови методом ВЭЖХ с диодно матричным детектором позволяет дифференцировать терапевтическую, токсическую и летальную концентрации и правильно интерпретировать аналитические результаты при установлении причины смерти.
похожие статьи
Особенности распределения 2,4- и 2,6-ди-трет-бутилгидроксибензола в организме теплокровных животных / Шорманов В.К., Цацуа Е.П., Асташкина А.П. // Судебно-медицинская экспертиза. — М., 2019. — №1. — С. 36-42.