К судебно-химическому доказательству отравлений эуноктином
/ Агальцова Т.Б. // Судебно-медицинская экспертиза. — М., 1976 — №1. — С. 23-27.

УДК 340.67:615.214.2
Кафедра токсикологической химии (зав.— проф.М. Д. Швайкова) I Московского медицинского института, Москва
К судебно-химическому доказательству отравлений эуноктином. Агальцова Т.Б. Суд.-мед. эксперт., 1976, № 1, с. 23-27
Предложена схема идентификации нитразепама и его метаболитов по бензофенонам и нативным соединениям с применением УФ-спектроскопии. Приведено доказательство в двух случаях отравлений таблетками эуноктина (нитразепама).
Схема 1. Иллюстраций 4.
FORENSIC TOXICOLOGICAL DEMONSTRATION OF INTOXICATIONS BY EUNOCTINUM
Т. B. Agaltzova
A proceeding permitting identification of nitrazepam and the metabolites by ben-zophenones and by native compounds with UV-spectroscopy is suggested. The compounds were detected chromatographicall.
Клиническая картина отравлений эуноктином не характерна. В организме нитразепам быстро подвергается восстановлению в 7-аминопроизводное, ацетилированию до 7-ацетамидопроизводного и гидролизу до двух бензофенонов: бензофенона нитразепама (2-амино-5-нитробензофенон) и бензофенона восстановленного нитразепама (2,5-диа-минобензофенон).
Приводим описание доказательства 2 случаев отравления таблетками эуноктина.В 1-м случае (подозрение на отравление 40 таблетками эуноктина) были доставлены печень, почка и желудок с содержимым месячной давности, во 2-м случае (подозрение на комбинированное отравление эуноктином, седуксеном, тизерцином, аминазином и циклодолом) — такие же органы.
Идентификация по бензофенонам (I) и нативным соединениям (II)

Исходя из химической структуры и свойств нитразепама, изолирование проводили извлечением водой, подкисленной 6 н. раствором соляной кислоты. Хлороформные извлечения, полученные в процессе изолирования, исследовали по разработанной нами методике. Идентификацию нитразепама и его метаболитов проводили по бензофенонам и нативным соединениям в соответствии со схемой. При этом идентификация по бензофенонам, обусловленная более высокой реакционной способностью последних по сравнению с нативными соединениями (кроме обнаружения по бензофенону 7-аминопроизводного), предполагает предварительное их обнаружение по собственным окраскам, свечению в УФ-свете и, что особенно важно, приводит к повышению чувствительности метода обнаружения нитразепама и 7-ацетамидо-производного. Для восстановленного нитразепама целесообразно обнаружение по нативному соединению, так как оно в 10 раз чувствительнее, чем обнаружение по бензофенону.
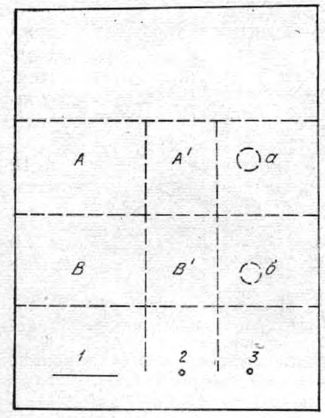
Рис. 1. Хроматограмма бензофенонов в
системе хлороформ — ацетон (9:1).
1 — 10 мл эфирного извлечения:
2 — 5 мл эфирного извлечения;
3 — метчики бензофенона нитразепама (а) и
бензофенона восстановленного
нитразепама (б).
При исследовании по нативным соединениям для очистки использовали хроматографию в тонком слое силикагеля, которая предусматривает предварительное хроматографирование части извлечения с метчиком нитразепама в системе метанол на забуференном 0,1 М раствором KHS04 слое силикагеля, в которой нитразепам и его метаболиты 1 имеют близкие значения Rf (нитразепам 0,78; 7-амино-производное 0,73; 7-ацетамидопроизводное 0,74; бензофенон нитразепама 0,85; бензофенон восстановленного нитразепама 0,71).
Идентификацию нитразепама и его метаболитов проводили после хроматографического исследования элюата зоны, параллельной метчику, в системе толуол — ацетон — 25% аммиак (50:50:1),позволяющей хорошо разделить исследуемые соединения в присутствии метчиков нитрозепама и его четырех метаболитов. Нитрозепам и 7-ацетамидопроизводное обнаруживали реактивом Драгендорфа. Установлено, что чувствительность реакции 10 мкг вещества в пятне повышается в 2 раза при последующей обработке пластинки 20% раствором серной кислоты. Для обнаружения ароматических аминов — 7-аминопроизводного и двух бензофенонов — наиболее чувствительна реакция азосочетания Браттона — Маршалла (чувствительность 0,05 мкг вещества в пятне для бензофенона нитразепама, 7-аминопроизводного и 0,5 мкг для бензофенона последнего). Поскольку нитразепам в данную реакцию не вступает, нами предложен наглядный подтверждающий тест, основанный на гидролитическом разрушении нитразепама на хроматографической пластинке, концентрированной соляной кислотой сразу после обработки реактивом Драгендорфа с последующим обнаружением продукта гидролиза — бензофенона нитразепама.
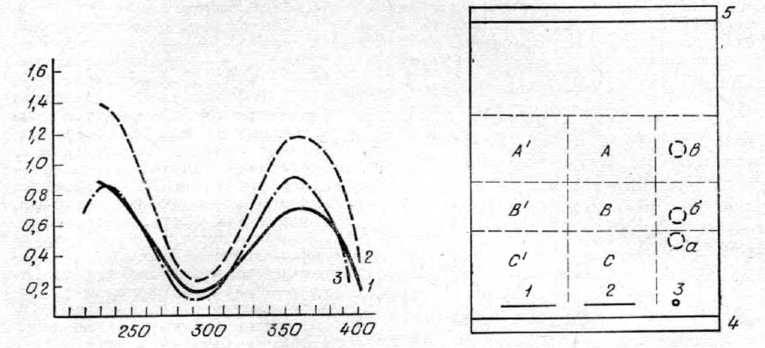
Рис. 2. Спектры поглощения бензофенона нитразепама, выделенного из желудка с содержимым, в 96° этаноле.
1 — из кислого раствора; 2 — из щелочного раствора; 3 — спектр поглощения бензофенона нитразепама в 96° этаноле (С 10 мкг/мл).
Рис. 3. Хроматограмма элюата нативных соединений в системе толуол — ацетон — 25% аммиак (50:50:1).
1 — элюат из 10 хлороформного извлечения; 2 — элюат из 5 мл хлороформного извлечения; 3 — метчики ацетилированного производного восстановленного нитразепама (а), восстановленного нитразепама (б) и нитразепама (в); 4 и 5 — прокладки из алюминиевой фольги.
Таким образом, можно обнаружить до 0,5 мкг нитразепама в пятне.
Хроматографическое обнаружение нитразепама и его метаболитов, основанное на реакциях окрашивания, сочетали с исследованием элюатов в УФ-области спектра.
Исследование вели в несколько этапов.
1. Нитразепам изолировали водой, подкисленной 6 н. раствором соляной кислоты до pH 1,0, затем настаивали 2 ч, отделяли центрифугированием при 3000 об/мин в течение 30 мин и сливали через ватный тампон в делительную воронку. Экстрагировали смесью растворителей хлороформ — этилацетат (1 : 1)2 трижды по 50 мл как и кислого
(pH 1,0), так и из щелочного (pH 10,0) раствора, каждый раз по 5 мин. Органический растворитель удаляли под вакуумом, остатки растворяли в хлороформе и доводили объем органической фазы до 50 мл. Исследовали параллельно кислые и щелочные извлечения.
2. К остатку аликвотной части хлороформного извлечения (10 мл), полученному после удаления органического растворителя, добавляли 10 мл 6 н. раствора соляной кислоты. Гидролиз проводили на глицериновой бане с обратным холодильником при 120° в течение 20 мин. Охлажденный гидролизат фильтровали, подщелачивали кристаллическим едким натром до pH 9,0—10,0, охлаждали, трижды экстрагировали эфиром (10, 5, 5 мл) и доводили раствор эфиром до 15 мл.
5 мл эфирного извлечения упаривали до объема 0,2—0,3 мл, наносили на хроматографическую пластинку в точку 2, а остальные 10 мл — в виде полосы в зону 1 (рис. 1). В качестве метчиков использовали спиртовые растворы бензофенонов, которые наносили в точку 3. Хроматографировали восходящим способом в системе хлороформ — ацетон (9:1). Длина пробега фронта растворителя 10 см. Бензофеноны хроматографировались в виде компактных окрашенных пятен: в первом случае — бензофенон 7-аминопроизводного в виде желто-оранжевого пятна (R/ 0,31), во втором — бензофенон нитразепама в виде желтого пятна (/?/ 0,64). В УФ-освещении наблюдали характерное свечение метчиков и параллельных им зон: бензофенон нитразепама светился темно-зеленым, а бензофенон 7-аминопроизводного — оранжевым светом. Для дальнейшего обнаружения закрывали зоны А к В, а оставшийся участок пластинки обрабатывали последовательно 2 н раствором соляной кислоты и 0,1% раствором азотистокислого натрия, через 1—2 мин 0,5% раствором сульфамата аммония и через 1—2 мин 0,1% раствором N-a-нафтилэтилендиамин-дихлорида (реакция Браттона—Маршалла). Бензофенон нитразепама при этом окрашивался в ярко-розовый, а бензофенон 7-аминопроизводного — в сиреневый цвет. Зоны А (желтая) и В (желто-оранжевая), параллельные окрашенным пятнам зон Л3 и В1 и метчиков, элюировали дважды по 5 мл смесью растворителей ацетон — метанол (9 : 1). Органический растворитель упаривали, остатки растворяли в 5 мл 96° этанола и снимали спектральные характеристики полученных бензофенонов в УФ-области спектра (рис. 2).
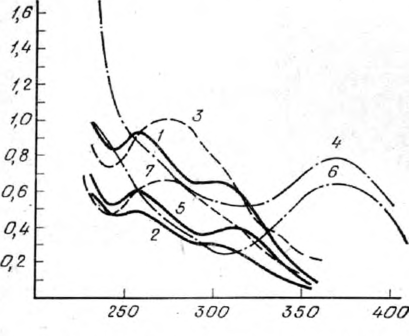
Рис. 4. Спектры поглощения нитразепама, выделенного из желудка с содержимым.
1 — в 96° этаноле — из щелочного раствора: 2 — в 96° этаноле — из кислого раствора; 9 — в кислой спирто-водной среде (в кюветы со спиртом добавляли по 2 капли 2 и. раствора соляной кислоты) — из щелочного раствора; 4 — в щелочной спирто-водной среде (в кюветы с кислыми спирто-воднымн растворами добавляли по 1 капле насыщенного раствора едкого натра); 5 — спектр поглощения нитразепама в 96° этаноле (С 10 мкг/мл); 6 — спектр поглощения нитразепама в щелочной спирто-водной среде; 7 — спектр поглощения нитразепама в кислой спирто-водной среде.
3. Извлечения (5 и 10 мл) отдельно после упаривания до небольшого объема наносили в виде полос на хроматографическую пластинку с забуференным 0,1 М раствором KHSO4 слоем'. В качестве метчика использовали спиртовой раствор нитразепама. Подвижной фазой при хроматографировании служил метанол. После высушивания под током холодного воздуха пластинку рассматривали в УФ-свете, отмечая зону свечения метчика реактивом Драгендорфа (оранжевое пятно с Rj 0,78), зоны, параллельные метчику, элюировали смесью ацетон — метанол (9:1) дважды по 5 мл. Органический растворитель упаривали под вакуумом до небольшого объема, наносили остатки на хроматографическую пластинку4 в зоны / и 2 в виде полос и хроматографировали в системе толуол—ацетон — 25% раствор аммиака (50:50:1) в присутствии метчиков: нитразепама, 7-амино- и 7-ацетамидопроизводных, спиртовые растворы которых наносили в точку 3 (рис. 3). После высушивания пластинки под током холодного воздуха отмечали зоны свечения метчиков в УФ-свете: Нитразепам — черное, 7-амино-производное—темно-зеленое и 7-ацетамидопроизводное — оранжевое пятна. Проявив метчики: нитразепама и 7-ацетамидопроизводного реактивом Драгендорфа {Rf 0,57 и 0,23 соответственно) и 7-аминопроизводного — реактивами для реакции Браттона— Маршалла (фиолетово-сиреневое пятно, Rf 0,31), зоны А, В и С проявляли теми же реактивами, что и метчики, закрыв при этом зоны А В] и С1. В первом случае в зоне В параллельно метчику 7-аминопраизводного появилось фиолетово-сиреневое окрашивание, в зоне А оранжевого окрашивания не наблюдалось. Во втором случае в зоне А параллельно метчику нитразепама появилось оранжевое окрашивание, в зоне В фиолетово-сиренового окрашивания не наблюдалось. В первом случае зону В1, во втором зону А1, параллельные окрашенным метчикам и зонам В и А, элюировали смесью ацетон — метанол (9:1) дважды по 5 мл. После удаления органического растворителя остатки растворяли в 5 мл 96° этанола и снимали спектральные характеристики в УФ-области спектра (рис. 4).
Затем зону А в обоих случаях обрабатывали концентрированной соляной кислотой до исчезновения оранжевого фона от реактива Драгендорфа. Хроматографическую пластинку накрывали стеклянной пластинкой, поместив по краям между ними прокладки из алюминиевой фольги шириной 0,5 см (см. рис. 3), и помещали в термостат при 100° на 40 мин. За 5 мин до конца гидролиза покровное стекло снимали, а пластинку оставляли в сушильном шкафу до полного улетучивания йода. После окончания гидролиза пластинку охлаждали. В зонах метчиков нитразепама и в зоне А во втором случае вместо оранжевых пятен появились желтые (в УФ-свете темно-зеленые), которые окрасились в ярко-розовый цвет после проведения реакции Браттона — Маршалла. В первом случае в зоне А розового окрашивания не наблюдалось.
Количественное определение обнаруженных веществ не проводили.
В первом случае в анализируемых объектах обнаружили восстановленный нитразепам, во втором — нитразепам. Наличие восстановленного нитразепама было доказано с помощью хроматографии в тонком слое по бензофенону и по нативному соединению. Спектральные характеристики бензофенона и нативного соединения в области 220—350 нм из-за низкой концентрации восстановленного нитразепама и влияния соэкстрактивных веществ получить не удалось.
Восстановленный нитразепам обнаружен только в щелочных извлечениях из печени, почек и желудка с содержимым, нитразепам — как в кислых, так и в щелочных извлечениях, причем в наибольшем количестве в желудке с содержимым, в гораздо меньших количествах в печени и почке.
Предполагаемую нами схему идентификации нитразепама и его метаболитов по бензофенонам и по нативным соединениям с применением УФ-спектроскопии можно применять в экспертизе.
1 Метаболиты нитразепама синтезировали по методике Shawada и соавт. (1970).
2 Мы убедились, что такая смесь является оптимальным экстрагентом для нитразепама и его метаболитов.
3 Массу для покрытия пластинок размером 9x12 см готовили смешением 2,6 г силикагеля марки “Woelm”, 0,2 г гипса и 7 мл 0,1 М раствора KHSO4.
4 Массу для покрытия пластинок размером 9X12 см готовили смешением 2,6 г силикагеля марки «Woelm», 0,2 г гипса и 6 мл воды.
похожие статьи
Несколько интересных случаев острого отравления сулемой / Лейбович Я.Л. // Судебно-медицинская экспертиза. — М.: Изд-во Наркомздрава, 1928. — №8. — С. 25-42.