Определение видовой специфичности крови методом спектроскопии оптического смешения
/ Арефьев И.М., Барсегянц Л.О., Еськов А.П., Алексеева В.И. // Судебно-медицинская экспертиза. — М., 1978 — №1. — С. 26-28.

Всесоюзный научно-исследовательский и испытательный институт медицинской техники (дир. — Р.И. Утямышев) Министерства здравоохранения СССР, Москва, Научноисследовательский институт судебной медицины (дир. — проф. В.И. Прозоровский) Министерства здравоохранения СССР, Москва
УДК 340.624.411
Определение видовой специфичности крови методом спектроскопии оптического смешения. Арефьев И.М., Барсегянц Л.О., Еськов А.П., Алексеева В.И. Суд.-мед. эксперт., 1978, № 1, с. 26-28.
Для регистрации реакции преципитации специфичности крови использован метод спектроскопии оптического смешения, обладающий значительно большей чувствительностью, чем применяемые в настоящее время в судебно-медицинской практике методы.
Иллюстрация 1.
SPECIES DIAGNOSING OF BLOOD BY LIGHT BEATING SPECTROSCOPY
I. M. Arefyev, L. O. Barsegyanz, A. P. Eskov, V. I. Alekseyeva
The technique was used to detect the precise results of the precipitation test. The method is more sensitive than the routine proceedings which are used now in forensic casework.
Необходимость в определении видовой специфичности крови возникает почти во всех случаях судебно-медицинского исследования кровяных пятен. Основным методом определения видовой принадлежности крови и других биологических объектов является реакция преципитации. Разработаны и используются различные способы проведения этой реакции — кольцепреципитация в жидкой среде, преципитация в геле, электропреципитация. В практической работе при определении видовой специфичности белков крови в пятнах часто возникают затруднения, связанные с ограниченным количеством исследуемого материала, слабой насыщенностью замытых пятен, большой давностью их. В таких случаях обычные методы определения вида не всегда дают положительные результаты. Отсюда возникает необходимость разработать такие варианты реакции преципитации, которые бы повышали ее чувствительность или позволяли обходиться минимальными количествами исследуемого объекта.
Для обнаружения наступившей преципитации мы применили метод спектроскопии оптического смешения (СОС) и установили, что он позволяет регистрировать реакцию преципитации при значительно больших разведениях антигена и антитела, чем обычный визуальный метод (И.М. Арефьев и соавт., 1977). В данной работе мы попытались использовать метод СОС для определения видовой специфичности крови.
Методика и материал. Узкий монохроматический луч от лазерного источника направляется в кювету, содержащую раствор исследуемого вещества (антигена или антител либо обоих вместе). Лазерный свет рассеивается вследствие флюктуаций концентрации растворенного вещества в объеме рассеяния, рассасывающихся со скоростью диффузии. Измеряется или спектр рассеянного света, или функция корреляции (коррелограмма), описывающая поведение флюктуаций концентрации во времени. Чем больше размер частичек растворенного вещества, тем меньше их коэффициент диффузии, тем медленнее рассасываются флюктуации концентрации и соответственно тем уже спектр и шире коррелограмма. Корреляционный метод регистрации имеет преимущества по сравнению со спектральным, основное из которых — более быстрое получение информации.
Если в растворе происходит реакция антиген — антитело, то в нем появляются частицы, более крупные, чем антиген и антитело, в результате средний коэффициент диффузии системы уменьшается и коррелограмма уширяется. Таким образом, в методе СОС реакция преципитации устанавливается по появлению коррелограмм, уширенных по сравнению с коррелограммами раствора антигена и антисыворотки.
Использовали корреляционный спектрометр английской фирмы Мальверн, модель •4300 (см. рисунок). Корреляционную функцию регистрировали при угле рассеяния 90°. Одновременно регистрировали и интегральную интенсивность рассеянного света. Реакцию преципитации осуществляли с вытяжкой пятна крови человека (КЧ) на марле, в разведениях последовательно от 1 : 103 до 1 : 106. Применяли сыворотки, преципитирующие белки человека, рогатого скота, птицы. Соотношение вытяжек крови и цельных сывороток было 9:1.
Коррелограммы регистрировали сразу после объединения раствора антигена и антисыворотки. Продолжительность регистрации 50 с.
Полученные результаты. При объединении растворов КЧ и антисыворотки человека (АСЧ) наблюдали уширенные коррелограммы во всем диапазоне разведений крови от 1 : 103 до 1 : 106. Чем больше была концентрация крови, тем значительней было уширение результирующих коррелограмм. При этом коррелограммы смесей К.Ч + АСЧ сопоставлялись с коррелограммой АСЧ, так как этот компонент рассеивал свет значительно сильнее, чем КЧ при всех разведениях. Эти результаты показывают, что реакция антиген — антитело проходит во всем диапазоне разведений крови.
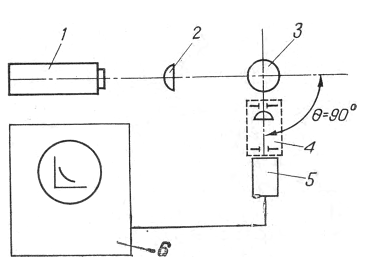
Блок-схема корреляционного спектрометра. 1 — гелий-неоновый лазер, длина волны излучения 0,63 мкм, выходная мощность излучения 5 мВт; 2 — фокусирующая линза; 3 — кювета с исследуемым образцом; 4 — приемная оптическая система; 5 — фотоэлектронный умножитель; 6 — коррелятор.
В двух сериях контрольных опытов, когда на кровь человека действовали антисыворотки птицы (АСП) и рогатого скота (АСРС), получили другие результаты. В смесях К.Ч+АСП не наблюдали сколько-нибудь существенного уширения коррелограмм по сравнению с коррелограммами исходных компонентов. Не наблюдали уширения коррелограмм и при записи их через 30 мин после объединения компонентов. Эти результаты свидетельствуют об отсутствии специфического взаимодействия антигена человека с несоответствующими ему антителами.
Аналогичные результаты получены и при постановке реакции с сывороткой, преципитирующей белок рогатого скота. Антисыворотка рогатого скота характеризуется более широкой коррелограммой, чем АСЧ и АСП. Интегральная интенсивность рассеяния в АСРС примерно в 2 раза больше, чем в КЧ при разведении 1 : 103, и примерно в 6 раз больше, чем в КЧ при разведении 1 : 106. В отсутствие реакции результирующая кривая должна занимать промежуточное положение, приближающееся к АСРС, причем чем меньше концентрация крови, тем ближе результирующая коррелограмма должна быть к коррелограмме АСРС. Именно такую картину наблюдали в эксперименте. Таким образом, результаты этой серии опытов показывают, что данная сыворотка также не образовала преципитата с гетерологичным антигеном.
В целом полученные результаты показывают, что видовую принадлежность крови можно определять методом СОС. Анализ можно проводить со значительно меньшими количествами крови, чем при других методах. Положительные результаты получаются вплоть до разведений крови 1 : 106. Контрольные опыты с антисыворотками рогатого скота и птицы показывают, что высокая чувствительность метода не приводит к потере специфичности.
Быстрота и чувствительность метода позволяют регистрировать иммунологическую реакцию на ранних стадиях и наблюдать течение реакции во времени. При этом измерения в первой фазе иммунологической реакции, когда размер ассоциатов не превышает длины волны лазерного света (случай рэлеевского рассеяния), являются даже предпочтительными, так как здесь работает простая физическая модель среды, обеспечивающая полное количественное описание результатов опыта.
Изучение возможности применения метода спектроскопии оптического смешения желательно продолжить при определении видовой специфичности других биологических объектов, а также при постановке других серологических реакций, применяемых в судебно-медицинской практике.
похожие статьи
Определение групповой принадлежности изолированных клеток влагалищного эпителия / Локтева Р.В., Локтев А.И., Шишкина Ж.А., Курзин Л.М. // Избранные вопросы судебно-медицинской экспертизы. — Хабаровск, 2022. — №21. — С. 78-82.
Использование методики окрашивания препаратов раствором акридинового оранжевого при определении групповой принадлежности изолированных клеток с помощью реакции смешанной агглютинации / Локтева Р.В., Королева М.В., Панасенко С.В., Курзин Л.М. // Избранные вопросы судебно-медицинской экспертизы. — Хабаровск, 2022. — №21. — С. 73-78.
Метод избирательной абсорбции при определении кровяных групп в кровяных пятнах / Серебряников П. // Судебно-медицинская экспертиза. — М.: Изд-во Наркомздрава, 1928. — №8. — С. 3-7.
Судебно-медицинские экспертизы и исследования вещественных доказательств биологического происхождения в России (по материалам 2003—2017 гг.) / Ковалев А.В., Куприна Т.А., Самоходская О.В., Кондратова И.В. // Судебно-медицинская экспертиза. — М., 2018. — №6. — С. 29-32.
Обнаружение эклипсных антигенов в трупной крови / Локтева Р.В. // Избранные вопросы судебно-медицинской экспертизы. — Хабаровск, 2019. — №18. — С. 127-131.