Сравнительная оценка результатов некоторых методов и их модификаций, используемых для определения фенотипов системы Gc
/ Ильина Е.А. // Судебно-медицинская экспертиза. — М., 1978 — №3. — С. 26-29.

Научно-исследовательский институт судебной медицины (дир.— проф. В.И. Прозоровский) Министерства здравоохранения СССР, Москва
УДК 340.624.41:612.118.221.2
Сравнительная оценка результатов некоторых методов и их модификаций, используемых для определения фенотипов системы Gc. Ильина Е.А. Суд.-мед. эксперт., 1978, № 3, с. 26-29.
Метод электрофореза в полиакриламидном геле для диагностики фенотипов системы Gc в судебно-медицинских целях может быть использован только в случаях, если на фореграмме выявляются все основные фракции Gc. При нарушении этого условия требуется исследование этих образцов сыворотки крови методом иммуноэлектрофореза в агаровом геле.
Иллюстрация 1.
COMPARATIVE ASSESSMENT OF THE RESULTS OF SOME PROCEEDINGS AND THEIR MODIFICATIONS EMPLOYED FOR THE DETERMINATION OF GC-SYSTEM PHENOTYPES
E. A. Iliyna
The main modifications of electrophoresis in poliacrylamidic gel are compared with agarose gel electrophoretic methor in the Gc-grouping medico-legal practice.
Методы диагностики фенотипов системы Gc можно разделить на 2 группы: к 1-й относятся методы электрофореза в крахмальном и полиакриламидном геле (ПААГ), ко 2-й — методы электрофоретического разделения сыворотки крови в агаровом геле или на целлюлозоацетатных пленках с последующим выявлением иммунологических особенностей белка Gc посредством реакции преципитации при помощи сыворотки анти-Gc. Методы электрофореза в крахмальном геле и иммуноэлектрофореза на целлюлозоацетатных пленках не нашли широкого применения для диагностики фенотипов системы Gc в судебно-медицинских целях. Наибольшее распространение получил метод иммуноэлектрофореза в агаровом геле. Электрофорез в ПААГ находится в стадии разработки и применяется в основном при популяционных исследованиях.
Методика иммуноэлектрофоретического определения фенотипов системы Gc едина, общеизвестна и состоит в следующем: исследуемые сыворотки человека электро-форетически разделяют в 1 % агаровом геле на мединал-вероналовом буфере pH 8,6, затем в геле вдоль оси миграции сыворотки вырезают канал, в который вводят сыворотку анти-Gc. Во время инкубации происходит встречная диффузия разделенной исследуемой и преципитирующей сыворотки. В результате образуются соответствующие тому или иному фенотипу Gc полосы преципитации.
В настоящее время опубликовано более 500 статей, посвященных исследованию сывороточной системы Gc. Почти все исследования были проведены методом иммуноэлектрофореза в агаровом геле. Это объясняется высокой специфичностью, чувствительностью метода, простотой получения агарового геля, хорошей воспроизводимостью результатов при наличии необходимой для иммуноэлектрофореза сыворотки анти-Gc.
В последние годы все большее распространение получает метод электрофореза в ПААГ при проведении биохимических, клинических и судебно-медицинских исследований. Это объясняется простотой, высокой разрешающей способностью и чувствительностью метода (чувствительность электрофореза в ПААГ можно сравнить лишь с чувствительностью метода иммуноэлектрофореза), хорошей воспроизводимостью результатов; метод не требует дорогостоящей аппаратуры и диагностических сывороток.
В 1965 г. Kitchin предложил метод электрофореза в ПААГ для диагностики фенотипов системы Gc. Использован аппарат с охлаждающим устройством. Электрофорез проводили в 5% ПААГ с добавлением цианогум-41. Использовали два варианта трис-ЭДТА-боратного буфера pH 8,28 и 8,91. Оптимальные результаты Kitchin получил при использовании буферного раствора pH 8,28 и времени электрофореза 5 ч. При этом на фореграммах сыворотки групп Gc 1—1 были представлены в виде двух быстро движущихся полос, Gc 2—2 — в виде двух медленно движущихся полос, a Gc 2—1—в виде трех полос, содержащих как медленно, так и быстродвижущиеся компоненты.
По данным Н.А. Добротиной и соавт. (1974), при электрофоретическом разделении сыворотки крови человека методом электрофореза в ПААГ с использованием трис-боратного буферного раствора (pH 8,3) в постальбуминовой области выявлялось от 3 до 7 фракций. При этом достоверно диагностировался только фенотип Gc 1—1, который характеризовался двумя быстрыми и двумя-тремя медленными фракциями. Фенотипы Gc 2—1 и Gc 2—2 характеризовались большим количеством фракций, вследствие чего авторам не всегда удавалось диагностировать их.
В 1975 г. Н.Н. Старостиным предложена модификация определения фенотипов системы Gc методом электрофореза в ПААГ с использованием трис-глицинового буфера pH 8,3. Время электрофореза составило 40—45 мин. Для более качественного разделения белков Gc Н.Н. Старостин рекомендует исследуемую сыворотку инкубировать с раствором гемоглобина, избегая ее перенасыщения. Окраска гелевых столбиков производится поэтапно: вначале фиксирование геля в трихлоруксусной кислоте,, затем троекратное отмывание геля в дистиллированной воде и последующее окрашивание в кипящей водяной бане в растворе амидо черного. По данным автора, фенотип Gc 2—2 характеризуется одной медленно мигрирующей фракцией и как исключение в непосредственной близости от нее может располагаться едва заметная фракция II-а; для Gc 2—1 характерны две фракции равной интенсивности, имеющие быстро и медленно движущиеся компоненты. Весьма редко эта разновидность Gc может иметь едва заметный третий компонент III-b, обладающий большей скоростью миграции. В редких случаях в непосредственной близости к альбумину можно выявить едва заметную фракцию IV-a.
Мы апробировали методику Kitchin, использовав аппарат фирмы «Reanal» без охлаждающего буфер устройства. В качестве переходного буфера применяли рекомендуемый Kitchin трис-ЭДТА-боратный буфер с pH 8,28. К сожалению, состав исходных буферов в статье не приведен, поэтому мы применили широко распространенный трис-ЭДТА-боратный буфер по прописи, предложенной Davis (1964). Время электрофореза 2,5—3,5 ч при силе тока 2 мА на трубку в первые полчаса и 5 мА в последующем. Более подробно методика изложена в предыдущем сообщении1.
Для получения оптимальных результатов разделения белка Gc на фракции были изучены: 1) различные количества исследуемой сыворотки, 2) длина электрофоретического разделения сыворотки крови человека (для этой цели были использованы стеклянные трубочки длиной 10 и 12 см), 3) способы внесения исследуемой сыворотки, 4) различные сорта амидо черного Б и время окраски, 5) способы отмывания. В результате установлено, что оптимальное количество исследуемой сыворотки в смеси с 40% сахарозой в отношении 2 : 1 равно 0,04 мл; стеклянные трубочки можно применять длиной как 10, так и 12 см. Исследуемые сыворотки нужно подслаивать после установления геля в аппарат для электрофореза и заполнения камер переходным буфером. Удаление геля из трубочек является кропотливой операцией и ее лучше производить при помощи шприца с иглой из нержавеющей стали с отшлифованным концом. После заполнения шприца водой иглу медленно вводят вращающим движением между стенкой трубочки и гелем. Вода отслаивает гель от трубочек, и гелевый столбик извлекается. При использовании амидо черного Б различных партий получается различный эффект окраски. Краситель может быть приготовлен на 7% растворе уксусной кислоты, на ледяной уксусной кислоте с добавлением или без добавления метанола. Оптимальные результаты мы получали при использовании амидо черного с добавлением метанола и ледяной уксусной кислоты. При этом гелевые столбики получались более прозрачными, а полосы были видны более четко (время окраски 10 мин). Хорошие результаты получены при окраске 1% раствором амидо черного в 7% растворе уксусной кислоты (время окраски 15—30 мин). Следовательно, для каждой партии красителя нужно подбирать оптимальные условия. Приготовленный краситель может храниться до 1 го да. Изучено два способа отмывания: электрофоретический и основанный на явлениях диффузии. Электрофоретическое отмывание проводилось в течение от 10 мин до 1 ч при силе тока от 600 до 50 мА. При этом результаты были неудовлетворительными — наблюдалось либо полное обесцвечивание геля в постальбуминовой области, либо недостаточное отмывание. Поэтому мы предпочли отмывание в 7% растворе уксусной кислоты. Это отмывание было более щадящим, но по времени более длительным. Хранить гелевые столбики рекомендуется в 7% растворе уксусной кислоты.
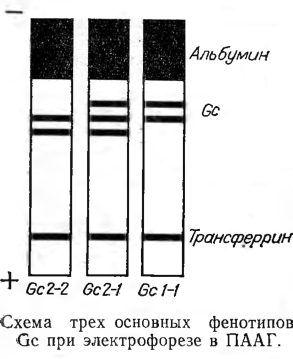
Отработку методики проводили на образцах сыворотки крови с заведомо известными группами Gc. После этого 96 образцов сыворотки крови с неизвестными группами Gc исследовали двумя методами: электрофореза в ПААГ и иммуноэлектрофореза в агаровом геле. Различий в диагностике Gc не наблюдали. При этом на фореграмме при электрофорезе в ПААГ белок Gc 1—1 разделялся на две быстро движущиеся фракции, Gc 2—2 — на две медленно движущиеся фракции, a Gc 2—1 — на три фракции, содержащие быстро и медленно движущиеся компоненты (см. рисунок).
При сравнении результатов, полученных при использовании различных модификаций метода электрофореза в ПААГ, установлено, что качество разделения белка Gc на фракции различно.
Классическое разделение белка Gc получается по методу Kitchin и разработанной на его основе нашей модификации. По модификации Н.А. Добротиной и соавт., как указывают сами авторы, дифференцирование групп Gc 2—2 и Gc 2—1 удается не всегда. Большое количество фракций белка Gc, по нашему мнению, получается в результате неправильной расшифровки фореграммы, когда некоторые белковые фракции, находящиеся в области а2-глобулинов, расценивают как фракции белка Gc. О качестве разделения белка Gc на фракции по данной методике мы судить не можем, так как приведенные фореграммы очень слабо выражены и нечетки.
Наличие едва заметных, не всегда проявляющихся полос при модификации Н.Н. Старостина свидетельствует о недостаточной воспроизводимости результатов и неполном разделении белка Gc на фракции, что подтверждается данными Parker и соавт. (1963) и Bearn и соавт. (1964).
Parker, Cleve и Bearn при применении электрофореза в крахмальном геле получили фореграмму, близкую к фореграмме Н.Н. Старостина. При этом авторы подчеркивают, что наличие слабых, дополнительных, не всегда проявляющихся полос может привести к ошибке в диагностике фенотипов Gc и рекомендуют свой метод для диагностики редких фенотипов этой системы. Введение же в буфер гидрооксида лития, по данным Bearn, Kitchin и Bowman, улучшает электрофоретические условия и дает возможность четко дифференцировать основные фенотипы системы Gc. При этом фенотипы Gc 1—1 и Gc 2—2 характеризуются двумя ясно различными фракциями, а фенотип Gc 2—1 — тремя фракциями почти равной интенсивности.
При сравнении методов иммуноэлектрофореза в агаровом геле и электрофореза в ПААГ, применяемых для диагностики фенотипов системы Gc, в настоящее время трудно сказать, какой из этих методов имеет большие преимущества. Во всяком случае ясно, что они не исключают друг друга и каждый из них имеет свои преимущества и трудности. Определение фенотипов Gc с помощью иммуноэлектрофореза позволяет исследовать одновременно до 20 образцов сывороток крови, а с помощью электрофореза в ПААГ — 12. При иммуноэлектрофорезе все образцы исследуемых сывороток находятся на одной пластинке, при электрофорезе в ПААГ каждая сыворотка разделяется как бы в отдельном блоке, который впоследствии нужно отдельно окрашивать л отмывать, что менее удобно. Кроме того, не исключена возможность повреждения гелевого столбика при извлечении геля из стеклянных трубочек. Оба метода позволяют диагностировать фенотипы Gc в 90% случаев при первичном исследовании. В то же время метод электрофореза является незаменимым в тех случаях, когда производство сывороток анти-Gc для всех судебно-медицинских лабораторий еще не налажено. Наличие двух методов особенно желательно, если получаются сомнительные результаты при использовании одного из методов я встречаются редкие варианты фенотипов системы Gc.
По нашему мнению, метод электрофореза в ПААГ можно применять для судебно-медицинских целей в тех случаях, когда на форе-грамме выявляются все основные фракции Gc в классическом виде, т. е. для фенотипов Gc 1—1 и Gc 2—2 — по две фракции, а для Gc 2—1—три фракции равной или почти равной интенсивности. При меньшем количестве фракций и появлении дополнительных правильность диагностики фенотипов Gc сомнительна и требует обязательного исследования этих образцов сыворотки крови методом иммуноэлектрофореза в агаровом геле.
1 Первый Всесоюзный съезд судебных медиков (Тезисы докладов). Киев, 1976, с. 481—482.
похожие статьи
Определение групповой принадлежности изолированных клеток влагалищного эпителия / Локтева Р.В., Локтев А.И., Шишкина Ж.А., Курзин Л.М. // Избранные вопросы судебно-медицинской экспертизы. — Хабаровск, 2022. — №21. — С. 78-82.
Использование методики окрашивания препаратов раствором акридинового оранжевого при определении групповой принадлежности изолированных клеток с помощью реакции смешанной агглютинации / Локтева Р.В., Королева М.В., Панасенко С.В., Курзин Л.М. // Избранные вопросы судебно-медицинской экспертизы. — Хабаровск, 2022. — №21. — С. 73-78.
Метод избирательной абсорбции при определении кровяных групп в кровяных пятнах / Серебряников П. // Судебно-медицинская экспертиза. — М.: Изд-во Наркомздрава, 1928. — №8. — С. 3-7.
Судебно-медицинские экспертизы и исследования вещественных доказательств биологического происхождения в России (по материалам 2003—2017 гг.) / Ковалев А.В., Куприна Т.А., Самоходская О.В., Кондратова И.В. // Судебно-медицинская экспертиза. — М., 2018. — №6. — С. 29-32.
Обнаружение эклипсных антигенов в трупной крови / Локтева Р.В. // Избранные вопросы судебно-медицинской экспертизы. — Хабаровск, 2019. — №18. — С. 127-131.