Реакция абсорбции — элюции при определении групп системы АВО в волосах
/ Стегнова Т.В. // Судебно-медицинская экспертиза. — М., 1977 — №2. — С. 34-37.

(Москва)
УДК 612.118.221.2-08:612.799.1-08
Реакция абсорбции — элюции при определении групп системы АВО в волосах. Стегнова Т.В. Суд.-мед. эксперт., 1977, № 2, с. 34-37.
В отрезках длиной 4—5 мм, взятых из различных участков стержня волос головы мужчин и женщин разного возраста, определяли группы системы АВО реакцией абсорбции — элюции. Разработаны оптимальные параметры указанной реакции для исследования волос.
Таблиц 3.
ABSORPTION-ELUTION TEST IN АВО GROUPING OF HAIR
T V. Stegnova
Absorption-elution test (AET) gives the best results in the ABO grouping of hair when the antibodies are eluted directly into the erythrocyte suspension at +40°C. The temperature of +56°C proved to be unsuitable because of a combination of a certain weakening of the a and lectine anti-H elution with a significant decreasing of erythrocyte agglutinability. Optimal AET parameters have been worked out.
Для обнаружения группоспецифических антигенов в объектах судебно-медицинской экспертизы широко применяют реакции абсорбции— элюции (РАЭ) и «смешанной агглютинации» (РСА).
При исследовании, например, волос и костей использование РСА в силу особенностей тканей, содержащих антигены, оказывается технически менее целесообразным, чем применение РАЭ. Мы исследовали волосы головы мужчин и женщин разного возраста. Опыты проводили с отрезками волос 4—5 мм, взятыми из различных участков волосяного стержня.
Поскольку большинство авторов рекомендуют элюировать абсорбированные антитела в физиологический раствор при 56°С, а затем уже выявлять их соответствующими стандартными эритроцитами, первоначальные опыты проводили именно таким способом. Получили малоудовлетворительные результаты: если и удавалось обнаруживать элюированные антитела, то агглютинация даже при минимальном объеме физиологического раствора была слабой, что особенно касалось антител а и лектина анти-Н. Объяснение этого мы видим в следующем. Абсорбционная способность антигенов А и 0 (Н) в волосах, очевидно, невелика, в связи с чем извлекается малое количество абсорбированных антител, концентрация которых к тому же уменьшается благодаря объему жидкости, куда они попадают (физиологический раствор + среда взвеси эритроцитов). Поэтому антитела не улавливаются при помощи реакции агглютинации. Это подтверждается данными, полученными в отношении волос группы В: высокая абсорбционная способность антигена В, как правило, обеспечивает выявление антител, даже извлеченных в физиологический раствор.
Пришлось перейти к элюции антител непосредственно во взвесь эритроцитов. При сроках абсорбции 3 и 20 ч и элюции антител при температуре 56°С в волосах группы В соответствующий антиген обнаруживали достаточно отчетливо, с волосами же групп А и 0 результаты были весьма слабыми или отрицательными.
Исход РАЭ, несомненно, должен зависеть от количества извлеченных антител, с одной стороны, и от агглютинабельности стандартных эритроцитов, с другой.
Оптимальная температура внешней среды для эритроцитов, равно как и для других клеточных элементов тканей человека, 37°С. Повышение ее не оказывает пагубного влияния только до известных пределов. Karle и соавт. (1970), исследуя мембраны эритроцитов человека при температурных воздействиях, установили, что в пределах 37—42°С эритроциты не претерпевают изменений в форме и способности к агглютинации. Изучая влияние температуры на агглютинацию эритроцитов М и N, М.А. Бронникова (1942) отметила, что при температуре 50°С возникают повреждения эритроцитов — выбухания вещества, которые затем отшнуровываются в виде мелких образований округлой формы. Наряду с этим наблюдалась утрата эритроцитами групп М и N способности к агглютинации. При охлаждении препаратов эта способность восстанавливалась лишь частично.
Ввиду того что малоудовлетворительные результаты РАЭ при температуре 56°С могли, в частности, зависеть от снижения агглютинабельности эритроцитов, мы провели специальные эксперименты. Сыворотки о и р по 2 серии и экстракт анти-Н разводили физиологическим раствором до предельного титра (кратные разведения). Каждый реагент во всех разведениях испытывали эритроцитами двух доноров. Эритроциты групп А и В применяли в виде 1%, а эритроциты группы 0 — 2% взвеси в физиологическом растворе ив 1% растворе бычьего альбумина. При добавлении к сывороткам эритроциты прогревали 25 мин при температуре 40, 45 и 56°С. Смеси с эритроцитами групп А и В центрифугировали 4 мин при 1500 об/мин, а с эритроцитами группы 0 —2 мин при 1000 об/мин. Пробирки четырехкратно встряхивали и учитывали результаты реакции агглютинации макро- и микроскопически сразу после центрифугирования и после пребывания смесей при комнатной температуре в течение 3 ч1.
Полученные результаты представлены в табл. 1.
Прогревание эритроцитов групп А и В при температуре 40°С не изменило степени их агглютинабельности, при температуре 45°С агглютинационная способность была ослаблена в 2 раза. При температуре 56°С агглютинабельность эритроцитов снижалась в 8—12 раз, причем имел место частичный, а в некоторых случаях и полный гемолиз эритроцитов. Агглютинационная способность эритроцитов группы 0 при температуре 40 и 45°С оказалась одинаковой и степень ее не отличалась от первоначальной (комнатная температура), а при 56°С снижалась в 4—8 раз. Спустя 3 ч агглютинабельность эритроцитов несколько повышалась, но была слабее исходной в 4 раза в группах А и В и в 2 раза в группе 0. Гемолиз усиливался.
Таблица 1
Агглютинабельность эритроцитов при различном температурном воздействии
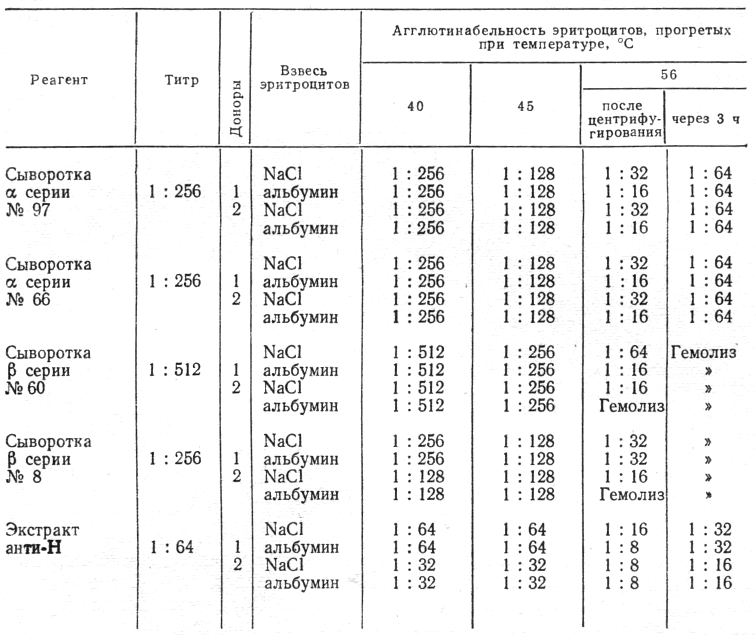
Примечание. «NaCl» — взвесь эр итроцитов сделана в физиологическом растворе, «альбу мин» — взвесь эритроцитов приготовлена в 1% растворе бычьего альбумина.
Из этих опытов следует, что пользоваться температурой 56°С для элюции антител непосредственно во взвесь эритроцитов нецелесообразно.
Требовалось снизить температуру, но предварительно необходимо было выяснить, в какой мере то или иное температурное воздействие обеспечивает при исследовании химически обработанных и раздавленных волос и волос, подвергшихся только раздавливанию под прессом, нарушение комплексов антиген — антитело и элюцию антител. Антитела элюировали в минимальный объем физиологического раствора в пробирках при различных температурных режимах (40, 45 и 56°С), добавляя затем малые капли взвеси эритроцитов. В табл. 2 приведены результаты опытов с химически обработанными волосами, так как эта обработка не только не препятствовала элюции достаточного количества антител, но, наоборот, улучшала исход РАЭ.
Если волосы относились к группе В, то антитела β элюировались во всех исследованных случаях, причем сила агглютинации варьировала от + + + до + —. В отношении волос, принадлежащих к группе А, получены иные данные: агглютинация была значительно слабее (+ —, +), причем наблюдались и отрицательные результаты. Примерно то же имело место и при исследовании волос группы 0 лектином анти-Н. Наибольшее число отрицательных реакций наблюдалось в группе А. Изменение температурного режима (40, 45, 56°С) не влияло сколько-нибудь заметно на элюцию антител при исследовании волос группы В. Что касается волос группы А и 0, то существенных различий между элюцией антител при 40 и 45°С не отмечено: температурный режим 56°С оказался наименее благоприятным, особенно при наличии волос у лиц, относящихся к секреторному типу se (преимущественно это касалось волос группы А).
Сочетая результаты изучения влияния температурного режима на степень элюции абсорбированных антител а, р и лектина анти-Н и на агглютинабельность эритроцитов, мы пришли к выводу, что для элюирования антител во взвесь эритроцитов в процессе исследования волос при помощи РАЭ температура 56°С не пригодна и что наиболее целесообразно проводить элюцию при температуре 40°.
Таблица 2
Степень элюции абсорбированных антител в физиологический раствор при разных температурных режимах
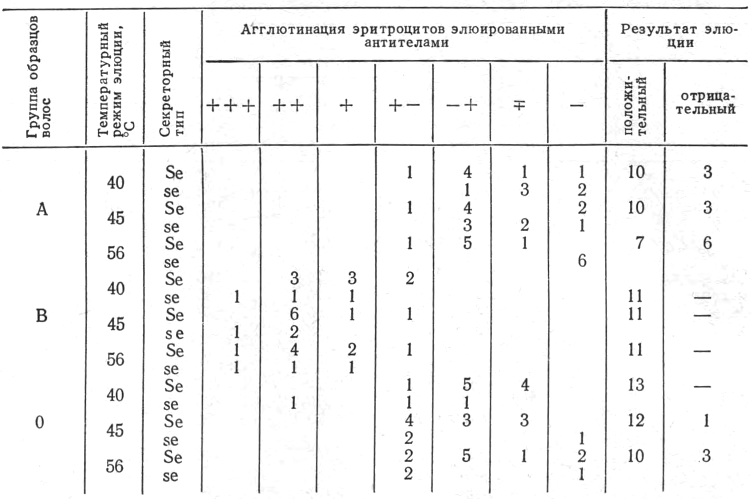
Обозначения. 1 Цифры обозначают число образцов волос. 2. + + + , + +, +, + -, - + , -+ агглютинация по убывающей степени выраженности, — отсутствие агглютинации.
Приводим разработанную нами методику исследования. Очищение волос от загрязнений путем промывания их теплой водой с мылом и последующее споласкивание водой без мыла. Обработка волос в течение 15—20 мин смесью, состоящей из двух объемов 15% раствора перекиси водорода и одного объема 5% водного раствора аммиака 2. Раздавливание волос между двумя металлическими пластинками под прессом. Добавление к ним на предметных стеклах по 1—2 капле сывороток а, р и экстракта анти-Н из семян ракитника сидячелистного с титром 1 :256 (допустим титр 1 : 128) s Абсорбция 3 ч при температуре 4—8°С (препараты должны находиться во влажных камерах). Отмывание волос от несвязанных антител в 5 порциях охражденного физиологического раствора. Добавление к волосам (соответственно примененным для абсорбции реагентам) 0,5% взвеси эритроцитов в 1% растворе бычьего альбумина или в сыворотке человека группы АВ 1,5% концентрации. Элюция антител непосредственно во взвесь эритроцитов в течение 25 мин при температуре 40°С. Микроскопический учет результатов РАЭ сначала без покровных стекол, а затем под ними после пребывания препаратов в течение 1 ч при комнатной температуре (в случае слабо выраженной агглютинации продолжительность наблюдения до 3 ч).
Изложенная методика была апробирована на экспериментальном материале — волосах головы 58 мужчин и женщин разного возраста с заранее установленными группой крови и секреторным типом (табл. 3).
Приведенная методика, как правило, обеспечивала обнаружение антигенов системы АВО в различных частях стержня волос головы лиц обоих секреторных типов Se и se.
Таблица 3
Результаты определения групповой принадлежности волос
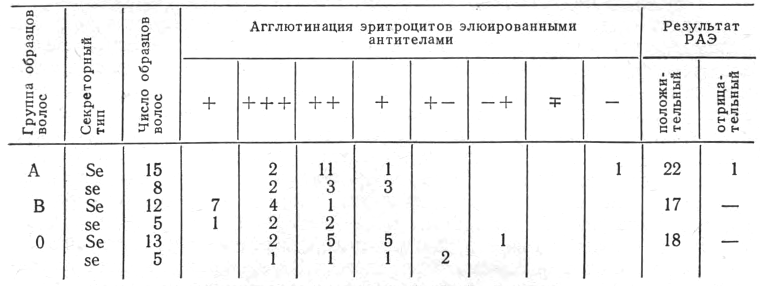
Примечание. Обозначения те же, что в табл. 2. + - макроскопически видимая агглютинация.
В нашем материале встретился один образец волос группы А, типа Se, в котором не был выявлен антиген А. Повышение температуры элюции до 56°С не дало результата. Тогда мы применили гемагглютинирующую гетероиммунную кроличью сыворотку анти-А. Это позволило отчетливо обнаружить антиген А. Исследование волос иммунными сыворотками продолжается.
Полученные нами данные позволяют полагать, что для выявления антигенов системы АВО и в других биологических объектах (кровь, выделения и пр.) элюирование абсорбированных антител во взвесь эритроцитов целесообразно проводить при температуре 40°С, а не при 56°С. Отрицательное воздействие на результаты РАЭ элюции при 56°С менее заметно при исследовании объектов с сильно выраженными антигенами, но все же оно существует и иногда может значительно ухудшать исход реакции абсорбции — элюции.
1 Максимальный срок наблюдения агглютинации при РАЭ.
2 Кисин М.В., Стегнова Т.В. «Суд.-мед. эксперт.», 1973, № 1, с. 22—26.
похожие статьи
Оптические свойства морфологически сходного волосяного покрова родственных животных / Бураго Ю.И. // Судебно-медицинская экспертиза. — М., 1976. — №2. — С. 49-52.