Определение ларусана в биологическом материале
/ Фартушный А.Ф. // Судебно-медицинская экспертиза. — М., 1977 — №2. — С. 46-48.

Донецкое областное бюро судебно-медицинской экспертизы (нач. А.Ф. Землянко)
УДК 340.67:615.281.221.1.033
Определение ларусана в биологическом материале. Фартушный А.Ф. «Суд.-мед. эксперт.», 1977, № 2, с. 46-48.
Предложена методика исследования биологического материала на ларусан. В свежем препарате границы обнаружения и определения 1 мг в 100 г объекта. В гнилостном материале граница обнаружения 2,5 мг, граница определения 4 мг в 100 г объекта.
Таблицы 3.
LARUSAN ESTIMATION OF BIOLOGICAL MATERIAL
A. F. Fartushny
A technique of analysis of biological material for larusan is described. The threshold of detection and estimation of larusan in fresh material is 1 mg/100 g of the object; in putrefied material the thresholds of detection and estimation of larusan are respectively 2,5 mg/100 g and 4 mg/100 g of the object.
Ларусан (изоникотиноилгидразон фурфуральацетона) при передозировке вызывает отравления, иногда смертельные. Судебно-химическое определение ларусана разработано недостаточно.
Особенности структуры ларусана указывают на целесообразность использования реакций с ферроцианидом калия, серной кислотой, 2,4-динитрофенилгидразином (2,4-ДНФГ), 1,2-нафтохинон-4-сульфокислотой и салициловым альдегидом. Нами разработаны оптимальные условия проведения этих реакций.
Реакция с ферроцианидом калия. К 1 мл раствора ларусана добавляли по 0,5 мл 5% раствора ферроцианида калия и ацетона, каплю 30% уксусной кислоты. Смесь нагревали до 50—60°. Наблюдали оранжевое окрашивание. Чувствительность 250 мкг. Реакцию давали также другие производные гидразида изоникотиновой кислоты (ИНК).
Реакция с салициловым альдегидом. К капле раствора ларусана в 1% соляной кислоте добавляли по капле насыщенного водного раствора салицилового альдегида и 5% раствора едкого натра, нагревали в кипящей водяной бане 20 мин, охлаждали и добавляли каплю 30% уксусной кислоты. Смесь наносили на фильтровальную бумагу и облучали 10—15 мин УФ-светом— наблюдалась зеленовато-желтая флюоресценция. Чувствительность 0,5 мкг. Реакция является общей для производных гидразида ИНК.
Реакция с серной кислотой. 2 капли спиртового раствора ларусана помещали в фарфоровую чашку и поджигали. После сгорания спирта и охлаждения добавляли каплю концентрированной серной кислоты, наблюдали зеленоватое окрашивание, при легком нагревании переходящее в розовое. Чувствительность 20 мкг. Реакция специфична для ларусана.
Реакция с 1,2-нафтохином-4-сульфокислотой. К 1 мл раствора ларусана в 1% соляной кислоте добавляли по 2 капли насыщенного раствора реагента в спирте и 30% раствора едкого натра. Наблюдали оранжевое окрашивание. Чувствительность 30 мкг. Аналогичное окрашивание давали салюзид, метазид, фтивазид и ИНГА-17. Коричневое окрашивание наблюдали у ИНК и ацетил-изониазида. Ипразид и гидразин окрашивания не давали.
Реакция с 2,4-ДНФГ. К 1 мл раствора ларусана в 1% соляной кислоте добавляли 1 мл 0,1% раствора реагента в 4 н. соляной кислоте. Через 1 ч добавляли 1 мл хлороформа и встряхивали. Наблюдали красное окрашивание хлороформного слоя. Каплю окрашенной жидкости наносили на предметное стекло и после испарения хлороформа наблюдали под микроскопом игольчатые призмы и их сростки в виде пучков. Чувствительность 20 мкг. Салюзид, ИНГА-17 и метазид давали желтое окрашивание, но без образования кристаллов. Фтивазид давал красное окрашивание и розетки мелких призм.
Хроматография в тонком слое. Хроматографирование ларусана и его гидразона проводили на пластинке (13X18 см), покрытой силикагелем КСК (5 г сорбента, 0,3 г гипса и 15 мл воды), в системе бензол — метанол (18:2). Длина пробега 15 см. Ларусан проявляли раствором п-диметиламинобензальдегида в концентрированной соляной кислоте. Гидразон ларусана имел собственную окраску, которую можно усилить смесью равных частей этанола 96° и 30% раствора едкого натра. Rf ларусана — 0,13, его гидразона — 0,7, других гидразонов: метазида — 0,48, фтивазида — 0,27, салюзида и ИНГА-17 — 0,11. Чувствительность хроматографического обнаружения 5 мкг.
Папаверин, морфин, дионин, кодеин, хинин, атропин, кокаин, пахикарпин, бен-зонал, барбамил, фенобарбитал, хлориндан, альдрин, гептахлор, гексахлоран, хлороформ и дихлорэтан окрашивания не давали. С концентрированной серной кислотой производные фенотиазина образуют соединения, окрашенные в другие цвета. Хлорофос, дихлофос и дихлорацетальдегид образуют желтого цвета гидразон с Rt 0,21.
Количественное определение. Л.И. Гребенник (1961) определял изониазид по реакции с ванадатом аммония в смеси серной и уксусной кислот. Е.Н. Вергейчик и соавт. (1967) использовали соляную кислоту, что привело к снижению чувствительности реакции. Мы использовали методику Гребенника, несколько изменив ее. Чувствительность для ларусана 100 мкг 1.
На основе реакции с 2,4-ДНФГ мы разработали более чувствительную методику определения ларусана. К 5 мл раствора ларусана в 1% соляной кислоте добавляли 1 мл 0,1% раствора 2,4-ДНФГ в 4 н. соляной кислоте. Перемешивали и через 1 ч добавляли 1 мл 30% раствора едкого натра и 3 мл этанола 96°. Оптическую плотность измеряли при 550 нм в кювете с толщиной слоя 10 мм. Подчинение закону Бера наблюдалось в пределах концентраций 25—1000 мкг.
Из данных табл. 1 следует, что изученные нами методики точны, воспроизводимы и дают сравнимые результаты.
Изолирование ларусана из биологического материала.
В.Ф. Крамаренко и 3. С. Рокач (1962), Е.О. Грязнава и соэвт. (1974) и другие авторы показали, что степень извлечения многих органических веществ зависит от природы экстрагента и электролитов, pH среды. Ларусан растворяется в воде и эфире (1 : 3300), бензоле (1 : 1000), изоамиловом спирте (1 :2500), хлороформе (1 : 200), этаноле (1 : 150), в 1% соляной кислоте (1 :50). Следовательно, наиболее перспективными для ларусана являются три последних экстрагента. Это учитывали при изучении влияния указанных выше факторов. К 5 мл 0,1% раствора ларусана в 1% соляной кислоте добавляли определенное количество хлорида натрия или сульфата аммония, добавлением 50% раствора едкого натра pH устанавливали в пределах 3—10, объемы уравнивали водой и производили извлечение хлороформом (I) и смесью хлороформа с этанолом 96° в соотношении 4:1 (II). Растворители выпаривали при 50°, а в остатках определяли ларусан по реакции с 2,4-ДНФГ. Наличие 10 и 20% электролитов и pH среды от 3 до 6 мало влияли на извлечение ларусана. Результаты экспериментов (среднее арифметическое из 4 параллельных опытов) показаны в табл. 2.
Таблица 1
Определение ларусана в таблетках
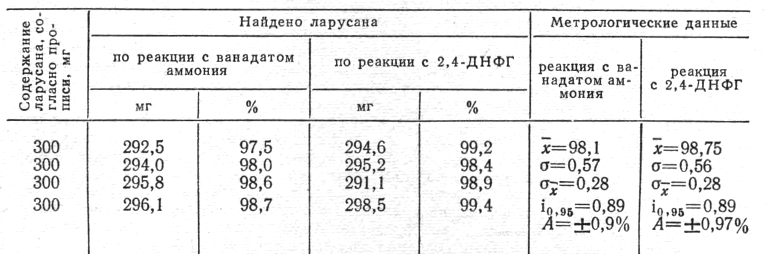
Таблица 2
Влияние pH среды и электролитов на степень извлечения ларусана
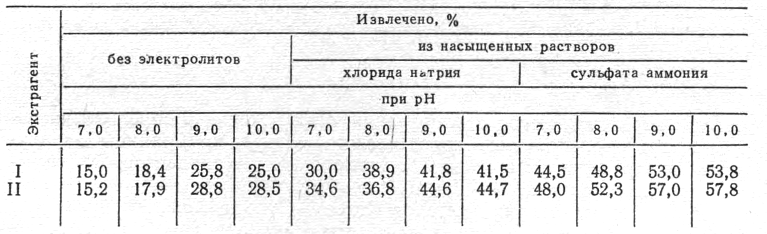
Таблица 3
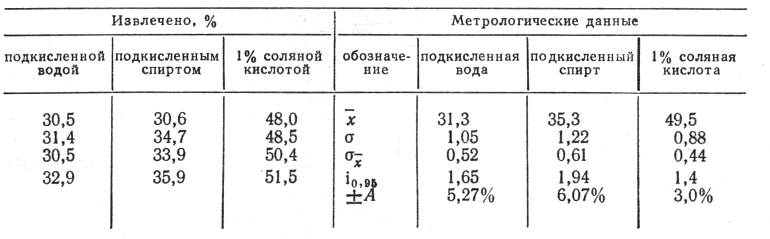
Степень извлечения ларусана из печени
Данные табл. 2 показывают, что максимальный выход достигается при извлечении смесью хлороформа с этанолом 96° в присутствии насыщенного раствора сульфата аммония и при pH 9—10. При этих условиях экстрагируется 57—57,8% ларусана.
Изолирование ларусана из печени. К 50 г измельченной печени добавляли 20 мг ларусана и оставляли на сутки. Изолирование проводили тремя методами: подкисленными спиртом и водой и 1% соляной кислотой. В первых двух методах использовали общепринятые рекомендации (М.Д. Швайкова, 1975), но извлечение ларусана производили смесью хлороформа с этанолом 96° (4:1) из растворов, насыщенных сульфатом аммония при pH 9. По третьему методу объект извлекали 50 мл 1% соляной кислоты, а затем промывали 25 мл. Объединенные жидкости насыщали сульфатом аммония и экстрагировали указанной выше смесью экстрагентов при pH 9.
В аликвотных частях (хлороформно-спиртовых экстрактов определяли ларусан по реакции с 2,4-ДНФГ (табл. 3).
Таким образом, изолирование 1% раствором соляной кислоты обеспечивает наиболее высокий выход ларусана из печени.
Методика исследования. 50 г измельченного объекта извлекали 50 мл 1% соляной кислоты при частом перемешивании в течение 2 ч. Смесь центрифугировали (10 мин при 3000 об/мин). Центрифугат сливали, а объект встряхивали с 25 мл кислоты 10 мин и вновь центрифугировали. Центрифугаты объединяли, добавляли сульфат аммония до насыщения, 50% раствор едкого натра до pH 9,0 и извлекали, не отделяя балластные вещества, смесью хлороформа и этанола 96° в соотношении 4:1 (5 раз по 50 мл). Извлечения объединяли и центрифугировали для разрушения эмульсии. Экстракт отделяли, а балластные вещества и водную жидкость, образовавшуюся при разрушении эмульсии, извлекали тем же экстрагентом (4 раза по 10 мл). Спиртовохлороформные извлечения объединяли и объем доводили до 250 мл.
Наличие ларусана доказывали описанными выше реакциями: с салициловым альдегидом, серной кислотой и 2,4-ДНФГ в сочетании с тонкослойной хроматографией гидразона. Каждую реакцию проводили с остатком, полученным после испарения в фарфоровой чашке при температуре 40—50° 50 мл извлечения.
Для количественного определения 50 мл извлечения выпаривали досуха при 50°. Остаток растворяли в 5 мл 1% соляной кислоты и проводили определение по реакции с 2,4-ДНФГ, как описано выше. При определении ванадатным методом солянокислый раствор нейтрализовали щелочью и доводили водой до 8 мл.
Границы обнаружения и определения составляют 1 мг ларусана в 100 г свежего объекта. При исследовании гнилостно разложившейся печени (давность 4 мес) балластные вещества снижают чувствительность методики. Граница обнаружения составляет 2,5 мг, а граница определения— 4 мг. При этом выход ларусана колеблется в пределах 26,6—39,2%. В контрольных опытах со свежей и гнилостно измененной печенью получены отрицательные результаты.
Выводы
- Разработан метод изолирования, обнаружения и определения ларусана при исследовании биологического материала. Границы обнаружения и определения: в свежем материале 1 мг, в гнилостном материале— соответственно 2,5 и 4 мг (в 100 г объекта).
- При использовании методов Стаса — Отто и Васильевой ларусан необходимо извлекать смесью хлороформа и этанола 96° (4:1) из растворов, насыщенных сульфатом аммония, при pH 9.
1 «Суд.-мед. эксперт.», 1972, № 1, с. 46.
похожие статьи
Перспективы использования параметров окислительной модификафии белков сыворотки крови для установления длительности агонального периода / Эделев И.С., Обухова Л.М., Андриянова Н.А., Эделев Н.С. // Судебная медицина. — 2019. — №3. — С. 28-32.
Обнаружение рокурония в биологических объектах методом высокоэффективной жидкостной хроматографии/масс-спектрометрии / Матвеева А.А., Федорова К.В., Лопушанская Е.М., Киреева А.В. // Судебная медицина. — 2019. — №2. — С. 49-51.
Изучение распределения неостигмина метилсульфата в организме теплокровных животных после внутрижелудочного введения / Алехина М.И., Шорманов В.К., Никитина Т.Н., Маркелова А.М. // Судебно-медицинская экспертиза. — М., 2019. — №2. — С. 40-47.
Обнаружение 25B-NBOMe — производного фенилэтиламина в биологическом материале / Барсегян С.С., Кирюшин А.Н., Ерощенко Н.Н., Туаева Н.О., Носырев А.Е., Кирилюк А.А. // Судебно-медицинская экспертиза. — М., 2019. — №2. — С. 34-39.
Особенности распределения 2,4- и 2,6-ди-трет-бутилгидроксибензола в организме теплокровных животных / Шорманов В.К., Цацуа Е.П., Асташкина А.П. // Судебно-медицинская экспертиза. — М., 2019. — №1. — С. 36-42.