Варианты постановки сравнительной реакции преципитации в агаре для дифференцирования крови филогенетически близких животных
/ Сулейменова Г.М. // Судебно-медицинская экспертиза. — М., 1977 — №3. — С. 38-40.

Ленинградское городское бюро судебно-медицинской экспертизы (нач. В.М. Кузьмин) Главного управления здравоохранения Ленгорисполкома
УДК 340.624.41:616-078.734
Варианты постановки сравнительной реакции преципитации в агаре для дифференцирования крови филогенетически близких животных. Сулейменова Г.М. Суд.-мед. эксперт., 1977, № 3, с. 38-40.
Для дифференцирования крови родственных животных предложены 2 модификации сравнительной реакции преципитации в агаре, в которых исследуется минимальное количество вытяжки из пятна крови одновременно 2—3 сыворотками, преципитирующими родственные виды белков.
Иллюстраций 2.
VARIANTS OF COMPARATIVE AGAR PRECIPITATION TEST FOR DIFFERENTIATING BLOOD OF PHYLOGENETICALLY CLOSELY RELATED ANIMALS
G. M. Suleimenova
Two modifications of comparative agar precipitation test are proposed allowing to examine a minimal quantity of a bloodstain extract simultaneously with two sera precipitating closely related protein species. Nature blood sera of animals which interest the investigator are recommended as control samples.
Для дифференцирования крови родственных животных В.И. Чарный (1966) рекомендовал сравнительную реакцию преципитации в агаре (СРПА), для опытов он использовал обычные преципитирующие сыворотки.
Первым этапом при исследовании пятен является выбор оптимальных разведений вытяжек из них. Это такие разведения, которые дают примерно сходную картину преципитации, например две полосы преципитата одинаковой интенсивности. При проведении второго этапа исследования— с выбранными разведениями вытяжек из исследуемого и контрольных пятен — рекомендуется располагать вытяжки в виде шестиугольника вокруг центральной лунки с сывороткой, причем каждую вытяжку помещать в 2 диаметрально противоположных отверстия.
Недостатком этой методики является то, что не всегда с помощью одной преципитирующей сыворотки можно окончательно решить вопрос о принадлежности крови в объекте тому или иному виду. Если в опыте применена сыворотка, не выявляющая специфического компонента белка исследуемого пятна, т. е. на линии преципитации между ним и сывороткой не формируется шпора, то это означает лишь, что кровь в исследуемом объекте не принадлежит тому виду животного, на белок которого изготовлена преципитирующая сыворотка. Более определенный вывод можно сделать, проведя исследование того же объекта с помощью других сывороток, преципитирующих белки родственных животных, для чего необходимо иметь дополнительное количество вытяжки из исследуемого пятна.
Так как других вариантов исследования крови близких животных не имеется, мы попробовали подобрать такую схему опытов, в которых минимальное количество исследуемого материала можно исследовать одновременно несколькими преципитирующими сыворотками.
Мы установили, что оптимальные концентрации белка-антигена для СРПА равны 1:100—1:300. Поэтому мы отказались от выбора оптимальных разведений вытяжек из пятен путем предварительной реакции преципитации в агаре, сократив тем самым срок исследования на 1—2 сут.. Для определения концентрации общего белка в вытяжке из исследуемого пятна использовали метод, предложенный В.П. Черновым (1971). Он заключается в следующем: готовят разведения вытяжки из пятна в 2, 4, 8.... 1024 раза. С каждым разведением проводят пробу с азотной кислотой и отмечают номер пробирки с концентрацией белка 1:1000. Рассчитывают исходную концентрацию белка (С) по формуле: С = 1:210-", где п — номер отмеченной пробирки. Мы внесли поправку в эту формулу с целью ориентировки на сывороточные белки в пятне, которые составляют примерно 1/2 - 1/5 часть экстрагируемых из пятна белков крови. Поэтому рассчитанную по формуле концентрацию белка уменьшали в 2—5 раз в зависимости от характера пятна.
Для СРПА мы предлагаем следующие варианты постановки опытов.
В случае, когда эксперт располагает 2 преципитирующими сыворотками, например на белок крупного и мелкого рогатого скота, их следует помещать в диаметрально противоположные отверстия шестиугольника (рис. 1, I, на вклейке). С 2 сторон от каждой сыворотки помещают вытяжки из контрольных пятен или антигены 2 родственных видов животных с соответствующей друг другу концентрацией сывороточного белка, учитывая спектр действия преципитирующей сыворотки, в нашем примере - коровы и бараны. Вытяжку из исследуемого пятна, соответствующим образом разведенную, вносят в центральную лунку.
При оценке результатов реакции следует иметь в виду, что точный вывод о принадлежности крови в исследуемом объекте можно сделать лишь в том случае, если одна из примененных сывороток выявляет специфический компонент антигена, отсутствующий хотя бы у одного из контрольных родственных белков. На это должно указывать формирование шпоры на линии преципитации между исследуемым пятном и какой-либо из двух преципитирующих сывороток, направленной в сторону антигена, отличного от исследуемого (реакция неполной идентичности). Одновременно наблюдается реакция идентичности со вторым антигеном, взятым для сравнения. В этом случае эксперт может сделать вывод, что кровь в исследуемом пятне принадлежит животному, на белок которого изготовлена сыворотка. Со второй преципитирующей сывороткой один из известных сравниваемых белков и исследуемое пятно также дают реакцию частичного сходства, но в этом случае шпора направлена от известного антигена, взятого для сравнения, в сторону исследуемого объекта, что указывает на несоответствие исследуемой крови данному антигену, так как эта сыворотка выявила в контрольном объекте белковый компонент, отсутствующий в исследуемом пятне. Рис. 1 демонстрирует результаты такого варианта исследования. В одном случае в исследуемом пятне кровь принадлежит крупному рогатому скоту, так как сыворотка, преципитирующая белок крупного рогатого скота, выявляет в нем дополнительный компонент, отсутствующий в крови барана (шпора направлена в сторону антигена барана), а с кровью коровы имеет место реакция идентичности. Сыворотка, преципитирующая белок мелкого рогатого скота, выявляет специфический компонент в крови барана, отсутствующий в белковом комплексе исследуемого объекта (шпора направлена от антигена барана к исследуемому объекту), что указывает на различие крови барана и исследуемой (см. рис. 1, I). В другом случае кровь в исследуемом объекте относится к мелкому рогатому скоту, так как специфический компонент в этой крови обнаруживает сыворотка, преципитирующая белок мелкого рогатого скота (шпора направлена в сторону антигена коровы), а кровь барана исследуемого пятна образует идентичный спектр преципитации с этой сывороткой (см. рис. 1, II).
Если ни одна из двух преципитирующих сывороток не выявляет специфический компонент в исследуемой крови, т. е. на линии преципитации ее не образуется шпора, то это указывает, что кровь не принадлежит ни корове, ни барану, а относится к какому-то другому родственному виду Для установления ее видовой принадлежности следует продолжить исследование с другими преципитирующими сыворотками.
Если эксперт располагает тремя преципитирующими сыворотками, возможен другой вариант постановки СРПА (рис. 2, I, на вклейке). В центральное отверстие шестиугольника также помещают вытяжку из исследуемого объекта. В периферические лунки помещают друг за другом I контрольный антиген, соответствующую ему сыворотку, II контрольный антиген, определяющую его сыворотку, III контрольный антиген и соответствующую преципитирующую сыворотку, открывающую этот белок. Результаты реакции оценивают аналогичным образом. Образование шпоры на линии преципитации исследуемого пятна с какой-либо преципитирующей сывороткой и одинаковый спектр преципитации с соседним родственным антигеном означают идентичность исследуемой крови и белка, на которой изготовлена данная преципитирующая сыворотка. На рис. 2 представлены результаты этого варианта исследования. Исследуемая кровь, принадлежащая корове (см. рис. 2, I), образует шпору с сывороткой, преципитирующей белок крупного рогатого скота. При принадлежности крови барану (см. рис. 2, II) видна шпора на линии преципитации ее с анти-бараньей сывороткой. На рис. 2, III исследуемая кровь принадлежит лосю, так как дополнительный компонент белка в ней выявляет сыворотка, преципитирующая белок лося. В то же время от двух других родственных антигенов, взятых для сравнения, к исследуемому пятну направлены шпоры, что исключает принадлежность крови в нем этим 2 видам белка.
Таким образом, с помощью описанных 2 вариантов методики возможно исследовать вытяжку из пятна в количестве 2—4 капель сразу с 2—3 преципитирующими сыворотками.
Эти варианты мы применили в 42 опытах с антигенами и пятнами крови коровы, барана и лося. Использовали неабсорбированные преципитирующие сыворотки, полученные иммунизацией животных каким-либо одним видом белка (Г.М. Сулейменова, В.И. Чарный, 1976). Для сравнения вместо контрольных пятен крови животных использовали нативные сыворотки (антигены), приготовляя разведения их, соответствующие приблизительному содержанию сывороточного белка в исследуемом пятне. Во всех опытах получили четкие результаты — шпоры формировались в соответствующих местах.
Выводы
- Для постановки сравнительной реакции преципитации в агаре предложены 2 варианта схемы опытов, в которых исследуется минимальное количество вытяжки из исследуемого пятна 2—3 преципитирующими сыворотками одновременно.
- В качестве объектов для сравнения с исследуемым пятном крови можно использовать как пятна крови родственных животных, так и их нативные сыворотки (антигены), предварительно уравняв концентрацию сывороточного белка в них.
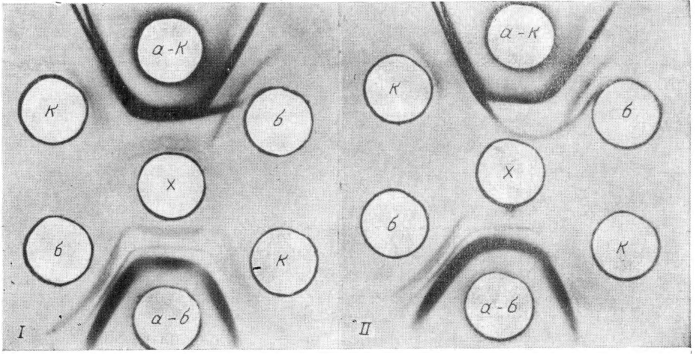
х — вытяжка из исследуемого пятна крови; к, б — контрольные антигены коровы и барана; а—к, а—б — соответственно сыворотки, преципитирующие белки крупного и мелкого рогатого скота.
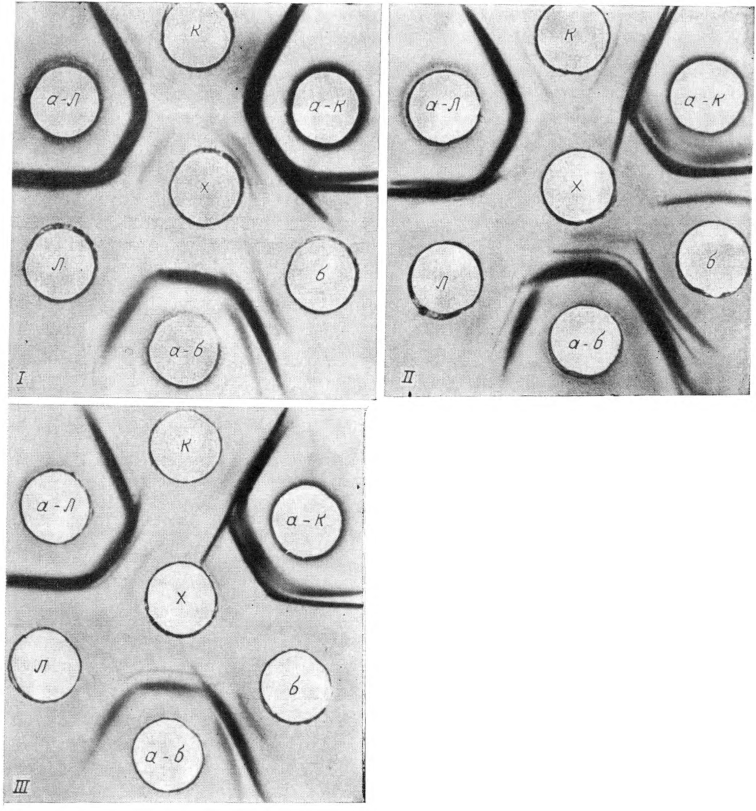
Рис. 2. СРПА с 3 преципитирующими сыворотками (I — коровы, II — барана, III — лося).
х — вытяжка из исследуемого пятна крови; к, б, л — контрольные антигены коровы, барана и лося; а—к, а—б, а—л — сыворотки, пре- ципитирующие белки коровы, барана и лося.
похожие статьи
Определение групповой принадлежности изолированных клеток влагалищного эпителия / Локтева Р.В., Локтев А.И., Шишкина Ж.А., Курзин Л.М. // Избранные вопросы судебно-медицинской экспертизы. — Хабаровск, 2022. — №21. — С. 78-82.
Использование методики окрашивания препаратов раствором акридинового оранжевого при определении групповой принадлежности изолированных клеток с помощью реакции смешанной агглютинации / Локтева Р.В., Королева М.В., Панасенко С.В., Курзин Л.М. // Избранные вопросы судебно-медицинской экспертизы. — Хабаровск, 2022. — №21. — С. 73-78.
Метод избирательной абсорбции при определении кровяных групп в кровяных пятнах / Серебряников П. // Судебно-медицинская экспертиза. — М.: Изд-во Наркомздрава, 1928. — №8. — С. 3-7.
Судебно-медицинские экспертизы и исследования вещественных доказательств биологического происхождения в России (по материалам 2003—2017 гг.) / Ковалев А.В., Куприна Т.А., Самоходская О.В., Кондратова И.В. // Судебно-медицинская экспертиза. — М., 2018. — №6. — С. 29-32.
Обнаружение эклипсных антигенов в трупной крови / Локтева Р.В. // Избранные вопросы судебно-медицинской экспертизы. — Хабаровск, 2019. — №18. — С. 127-131.