Сравнительная оценка методов выделения ареколина и кондельфина из биологического материала
/ Бисенбаев Э.М., Крамаренко В.Ф. // Судебно-медицинская экспертиза. — М., 1968 — №4. — С. 26-28.

УДК 340. 67:547. 944. 945
Кафедра токсикологической и аналитической химии (зав. — проф. В.Ф. Крамаренко) Львовского медицинского института
Comparative Assessment of Various Methods Permitting Isolation of Arecolinum and Condelphinum from Biological Material
E.M. Bisenbayev, V.F. Kramarenko
An original method of photoelectrocolorimetrical arecolinum hydrobromide estimation is proposed by the authors. It is based on the reaction with hydroxylaminum and ferrum chloride. Condelphinum is estimated photoelectrocolorimetrically in a reaction with tropeolinum 00.
В литературе описаны отравления животных жидкостью, из которой получают кондельфин (И.А. Гусынин, 1947), а также отравления ареколином (Р.М. Терникова, 1957).
Для выделения ареколина из биологического материала применяют методы, основанные на изолировании алкалоида водой, подкисленной щавелевой кислотой (А.А. Васильева, 1949), а также спиртом, подкисленным щавелевой кислотой по методу Стас-Отто (М.Д. Швайкова, 1965), и метод перегонки ареколина с водяным паром (Р.М. Терникова, 1957).
Мы поставили задачу — определить, сколько ареколина можно выделить каждым из указанных методов, а также изучить возможность применения методов Стас-Отто, А.А. Васильевой и В.Ф. Крамаренко для выделения кондельфина.
Для выделения ареколина (Р.М. Терникова) измельченный биологический материал перегоняют с водяным паром. Дистиллят собирают в 3 приемника, в которые предварительно вносят по 15 мл 1% раствора виннокаменной кислоты: в первый — 50 мл, во второй и третий — по 100 мл. Объединенные дистилляты троекратно взбалтывают с хлороформом (по 10 мл), подщелачивают раствором аммиака и снова трижды взбалтывают с хлороформом (по 10 мл). Хлороформ упаривают, а в остатках обнаруживают ареколин качественными реакциями.
Для количественного определения ареколина мы модифицировали фотоэлектроколориметрический метод, предложенный Tomash и Mejer (1962). Остатки, содержащие ареколин, растворяли в 1 мл воды; прибавляли 2 мл 10% раствора едкого натра в 90% метаноле, 1 мл 10% раствора солянокислого гидроксиламина в 80% этаноле и оставляли на 15 мин, периодически взбалтывая, приливали по 2 мл раствора соляной кислоты (1:3), 1 мл 10% раствора хлорида окисного железа в 0, 1 н. растворе соляной кислоты и объем жидкости доводили водой до 12 мл. При этом появлялось кирпично-красное окрашивание, оптическую плотность которого измеряли фотоэлектроколориметром ФЭК-М (светофильтр зеленый, кювета 20, 01 мм). Окрашивание соответствует закону Бугера—Ламберта—Бера в пределах от 0, 1 до 3, 4 мг ареколина в пробе. Чувствительность 0,1 мг ареколина в 1 мл раствора.
Таблица 1
Сравнительная оценка методов выделения ареколина (из 100 г материала)
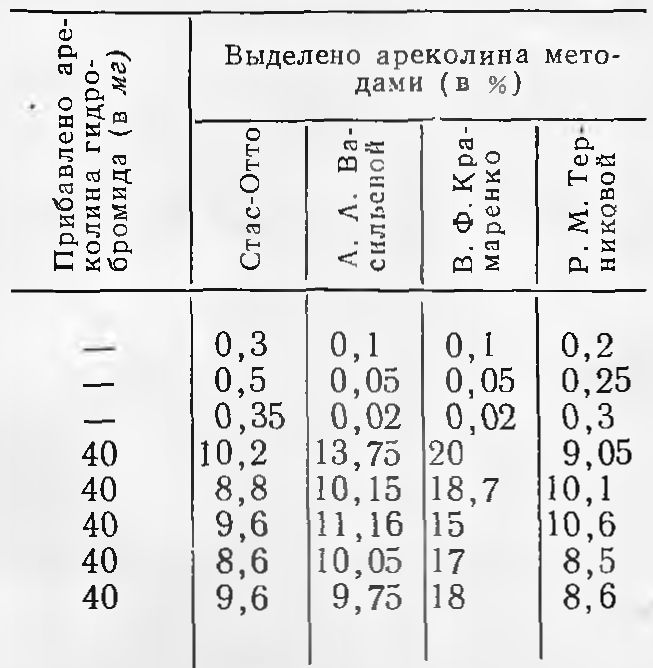
Таблица 2
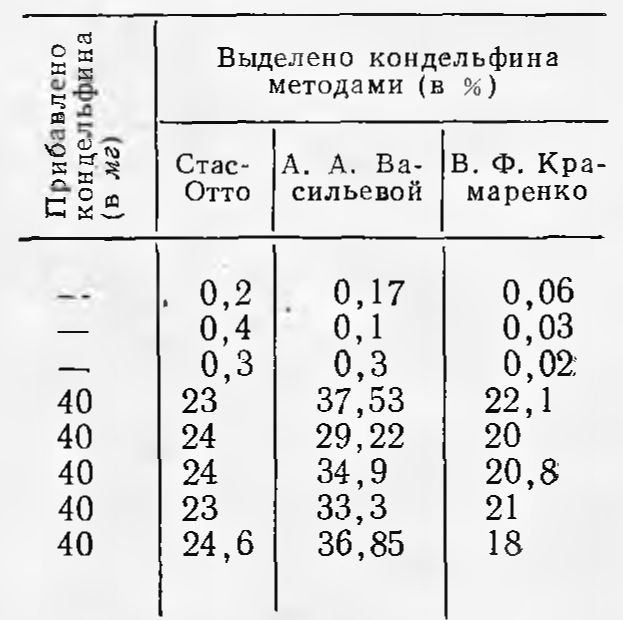
Сравнительные результаты выделения кондельфина из 100 г материала различными методами
Содержание ареколина рассчитывали по калибровочному графику.
Учитывая летучесть ареколина основания, хлороформные вытяжки из подщелоченных дистиллятов, полученных по методу Р.М. Терниковой, насыщали газообразным хлористым водородом, а затем испаряли хлороформ. Сухие остатки растворяли в 1 мл воды, а дальше поступали, как указано выше.
Так же насыщали газообразным хлористым водородом хлороформные вытяжки, полученные при выделении этого алкалоида методами Стас-Отто, А.А. Васильевой и В.Ф. Крамаренко. Ареколин выделяли этими методами из 100 г измельченной печени, взятой в течение суток после смерти, прибавляя 40 мг ареколина гидробромида.
Результаты приведены в табл. 1.
Приведенные в табл. 1 данные показывают, что наибольшее количество ареколина выделяется по методу В.Ф. Крамаренко, меньше — по методам А.А. Васильевой и Р.М. Терниковой и меньше всего — по методу Стас-Отто.
Методы выделения кондельфина из биоматериала в литературе не описаны. Поэтому возможность выделения этого алкалоида указанными выше методами мы проверили.
Для сравнительной оценки методов выделения кондельфина брали по 100 г свежей измельченной печени и к каждой пробе прибавляли по 20 мл раствора кондельфина (в 1 мл раствора — 2 мл препарата). Оставляли па сутки, а затем выделяли кондельфин.
Количество кондельфина обнаруживали по методу Haussler (1957), Haussler и Hajdu (1962), видоизмененному В.Ф. Крамаренко и З.С. Рокач (1962).
Остатки после отгонки хлороформа смывали 10 мл ацетатной буферной смеси (pH 4, 6), по 1 мл этого раствора вносили в делительные воронки. Прибавляли по 9 мл ацетатного буферного раствора (pH 4, 6), по 5 мл 0,1% раствора тропеолина 00 и по 5 мл хлорофоома, взбалтывали в делительных воронках с новыми порциями хлороформа (по 5 мл), пока 2—3 капли последней хлороформной вытяжки переставали окрашиваться от прибавления 2—3 капель 1% раствора концентрированной серной кислоты в метиловом спирте. Объединенные хлороформные вытяжки доводили хлороформом до 50 мл. 10 мл этого раствора вносили в колбочку объемом 50 мл, прибавляли 2,5 мл 1% раствора концентрированной серной кислоты в метиловом спирте. Появлялось красно-фиолетовое окрашивание, оптическую плотность которого измеряли фотоэлектроколориметром ФЭК-М (светофильтр зеленый, кювета 10, 045 мм).
Чувствительность метода 0, 1 мг кондельфина в пробе. Относительная ошибка измерений ±2, 4%. Окрашивание растворов соответствует закону Бугера—Ламберта—Бера в пределах концентраций от 0,1 до 1,4 мг кондельфина в пробе.
Содержание кондельфина в остатках определяли по калибровочному графику.
Результаты выделения кондельфина приведены в табл. 2.
Наибольшее количество кондельфина выделяется по методу А.А. Васильевой.
Выводы
- Количество ареколина в биологическом материале можно определять фотоэлектроколориметрически, используя реакцию с гидроксиламином, а количество кондельфина — реакцией с тропеолином 00.
- Для выделения ареколина из биологического материала, не подвергшегося гниению, наиболее эффективен метод В.Ф. Крамаренко, а для кондельфина — метод А.А. Васильевой.
Поступила в редакцию 27/X 1967 г.
похожие статьи
Перспективы использования параметров окислительной модификафии белков сыворотки крови для установления длительности агонального периода / Эделев И.С., Обухова Л.М., Андриянова Н.А., Эделев Н.С. // Судебная медицина. — 2019. — №3. — С. 28-32.
Обнаружение рокурония в биологических объектах методом высокоэффективной жидкостной хроматографии/масс-спектрометрии / Матвеева А.А., Федорова К.В., Лопушанская Е.М., Киреева А.В. // Судебная медицина. — 2019. — №2. — С. 49-51.
Изучение распределения неостигмина метилсульфата в организме теплокровных животных после внутрижелудочного введения / Алехина М.И., Шорманов В.К., Никитина Т.Н., Маркелова А.М. // Судебно-медицинская экспертиза. — М., 2019. — №2. — С. 40-47.
Обнаружение 25B-NBOMe — производного фенилэтиламина в биологическом материале / Барсегян С.С., Кирюшин А.Н., Ерощенко Н.Н., Туаева Н.О., Носырев А.Е., Кирилюк А.А. // Судебно-медицинская экспертиза. — М., 2019. — №2. — С. 34-39.
Особенности распределения 2,4- и 2,6-ди-трет-бутилгидроксибензола в организме теплокровных животных / Шорманов В.К., Цацуа Е.П., Асташкина А.П. // Судебно-медицинская экспертиза. — М., 2019. — №1. — С. 36-42.