Характеристика молекулярно-генетической индивидуализирующей системы на основе минисателлитного маркера D1S111
/ Ефремов И.А., Лебедева Н.Н., Земскова Е.Ю., Иванов П.Л. // Мат. VI Всеросс. съезда судебных медиков. — М.-Тюмень, 2005.

(Москва)
Введение
Полиморфный минисателлит D1S111 впервые был выявлен с использованием мультилокусного зонда 33.6 в прицентромерной области длинного плеча хромосомы 1 [1-4]. Этот маркер расположен на 3'-конце гена CD3Z, кодирующего белок-предшественник зета-цепи Т3-антигена - поверхностного гликопротеина Т-лимфоцитов (TiT3 комплекс). Сам минисателлит D1S111 локализован в области 1q23, а содержащая его референтная последовательность AL359962, общей потяженностью более 67 т.п.н. локализована в области 1q23.3-q25.1.
В этом локусе было выявлено не менее 14 аллелей, содержащих от 9 до 22 повторов, с гетерозиготностью от 53 до 72%.
В 1996 году отечественными авторами была предложена праймерная система для амплификации аллелей этого маркера, определена нуклеотидная последовательность одного из аллелей, предложена номенклатура аллелей согласно числу тандемных повторов, а также изучено частотное распределение аллелей в выборке из русской популяции г. Москвы [5]. Это обусловило последующее использование минисателлита D1S111 в качестве молекулярно-генетической индивидуализирующей системы в судебно-медицинских приложениях по установлению родства и идентификации личности на территории России и ближнего зарубежья.
Тем не менее, уровень полиморфизма этого маркера до настоящего времени был охарактеризован недостаточно полно и на относительно малочисленных выборках. Кроме этого, в литературных данных имеются определенные неясности и разночтения, касающиеся структурной организации аллелей данного локуса. Изучение этих вопросов представляется актуальным с точки зрения повышения эффективности судебно-медицинских молекулярно-генетических идентификационных исследований с использованием этого маркера.
Предметом настоящего исследования явился сравнительный анализ референтных нуклеотидных последовательностей для локуса D1S111. Также была поставлена задача определения основных параметров полиморфизма этого локуса в репрезентативной выборке российского населения с целью практического использования в качестве индивидуализирующей молекулярно-генетической системы на территории России.
Результаты и обсуждение
На первом этапе работы мы провели сравнительный анализ четырех известных нуклеотидных последовательностей, ограниченных локализацией использованных нами праймеров [5] (Табл. 1).
Отметим, что нуклеотидная последовательность минисателлита D1S111 впервые была представлена в электронной базе данных GenBank в 1993 году, согласно опубликованным ранее данным [1]. На конец 2004 года в этой базе данных было представлено три референтные последовательности для минисателлита D1S111 (см. Табл. 1). Четвертая известная нуклеотидная последовательность, соответствующая аллельному варианту 14, описана ранее в работе [5].
По результатам проведенного анализа можно сделать вывод, что тандемный повтор D1S111имеет в среднем длину 37 п.н. и состоит, в свою очередь, из трех субповторов (Табл. 2). В некоторых случаях длина каждого из этих субповторов может отличаться на 1-2 п.н. от указанной величины из-за внутренних делеций или (реже) вставок.
Суммарно, сравнительный анализ референтных нуклеотидных последовательностей позволяет предположить следующую "усредненную" структуру для этого минисателлита:
Консервативная последовательность à [полный повтор, 37 п.н.]n à[субповторы 2 и 3] à[полный повтор с делецией одного основания в субповторе №3, 36 п.н.] à Консервативная последовательность.
Так, например, исходя из этой схемы, "усредненный" аллель 13 минисателлита D1S111 должен состоять из 12 полных (или почти полных) повторов, и еще одного повтора, в котором отсутствует субповтор 1. Действительно, именно такая структура соответствует показанному на Рис. 1. фрагменту длиной 531 п.н. референтной последовательности AL359962.
Соответственно, усредненный размер наиболее короткого обнаруженного нами аллеля 9, амплифицируемого с использованием указанных праймеров, должен составлять 383 п.н. Рассчитанные подобным образом размеры для всех известных аллелей приведены во втором столбце Таблицы 3. Указывая эти размеры с точностью до 1 п.н. мы учитываем, однако, возможность их отличия в пределах нескольких (1-3) пар нуклеотидов внутри каждой аллельной группы из-за возможных нуклеотидных вставок и делеций. Указанные размеры аллелей отличаются от данных, приведенных в работе [5] на 2 п.н. и, на наш взгляд, являются более точными.
Эти данные были нами использованы как опорные параметры для определения основных характеристик полиморфизма локуса D1S111 в репрезентативной выборке российского населения.
Всего было обследовано более 1000 человек из разных регионов Российской Федерации преимущественно русской национальности (по паспортным данным). По своему составу это была выборка русских с включенными мигрантами из других популяций, которую можно охарактеризовать как выборку из гетерогенной популяции. В ходе настоящего исследования общая обследованная выборка была разбита на две группы. Первая группа (далее по тексту - выборка 1) была составлена из числа фигурантов судебно-медицинских экспертиз, назначенных в Бюро судебно-медицинской экспертизы Департамента Здравоохранения г. Москвы в 1999-2003 годах (594 неродственных человека). Вторая группа (далее по тексту - выборка 2), объемом в 545 неродственных человек, была сформирована из числа фигурантов судебно-медицинских экспертиз, назначенных в Российский центр судебно-медицинской экспертизы Минздрава России в 2001-2004 годах.
В качестве биологического материала для анализа использовали образцы периферической крови обследуемых лиц.
Для амплификации аллелей локуса D1S111 использовали праймерную систему, описанную в работе [5]. Разделение продуктов полимеразной цепной реакции (ПЦР) осуществляли в 1,5-2% агарозных гелях с последующей окраской бромистым этидием.
Аллельные варианты локуса D1S111 идентифицировали по внешним стандартам молекулярных масс двумя разными методами.
Для выборки 1 в качестве стандарта прямого соответствия использовали искусственно синтезированную "псевдоаллельную лестницу", содержащую 17 негомологичных фрагментов ДНК длиной от 381 до 973 п.н., с шагом в 37 п.н. Эти фрагменты по размеру соответствуют аллелям 9 - 25 минисателлита D1S111.
Аллельные варианты локуса D1S111 для выборки 2 определяли другим методом: не непосредственным поиском прямого соответствия по размеру, а опосредованно, расчетным путем с помощью аппаратно-программной системы Kodak EDAS 120 (Кодак, США) с использованием в качестве маркера ДНК pBR322/AluI. Для вероятностно-статистического анализа данных были использованы компьютерные программы RXC (G. Carmody, Ottawa, Канада), Arlequin [6], и PowerStats [7].
На рис. 2 и 3 показаны репрезентативные результаты типирования ПДАФ ДНК локуса D1S111 двумя разными методами: с использованием "псевдоаллельной лестницы" для этого маркера и высокомолекулярного стандарта ДНК pBR322/AluI.
В табл. 4 представлено распределение наблюдавшихся генотипов в двух исследованных выборках. В каждой выборке было выявлено около 40% генотипов от общего числа возможных. При этом для обеих выборок наиболее частыми оказались три генотипа: гетерозиготы 15-18, а также гомозиготы 18-18 и 15-15.
Всего нами было выявлено 18 аллелей, содержащих от 9 до 26 повторов (см. табл. 3). Наиболее распространенными оказались аллели 15 и 18, частота наблюдений которых превысила 0,33 в выборке 1 и 0,28 в выборке 2. Примечательно, что в ходе настоящего исследования было выявлено 4 новых, то есть не описанных ранее, высокомолекулярных аллеля для этого маркера: это аллели с 23 (901 п.н.) по 26 (1012 п.н.). При этом аллель 26 наблюдался только один раз в гетерозиготном состоянии в выборке 1.
Значения основных популяционных характеристик локуса D1S111 для обеих исследованных выборок приведены в табл. 5. По этим данным, нформативность D1S111 для исследованной выборки превышает или сравнима с информативностью таких минисателлитов, как IL1RN-VNTR, RB1-VNTR, IgH-5'VNTR, D17S5, но уступает таким индивидуализирующим системам как D1S80 и ApoB-3'VNTR [5, 8-11].
Количественная оценка степени различий распределения аллелей и генотипов между двумя исследованными выборками, и по сравнению с другими данными, не являлась предметом настоящего исследования. Эта работа нами проводится и данные будут опубликованы отдельно.
Тем не менее, на качественном уровне отметим следующее.
Распределение аллелей в целом оказалось весьма сходным в обеих выборках, за исключением двух моментов. Во-первых, для самого распространенного в выборке 1 аллеля 18 частота наблюдений в выборке 2 оказалась существенно ниже (0,376 против 0,284). Во-вторых, аллель 19 в выборке 2 наблюдался в 3,8 раза чаще по сравнению с выборкой 1 (0,137 против 0,036). Кроме этого, что уровень полиморфизма для выборки 2 оказался существенно выше по сравнению с выборкой 1.
Наиболее вероятное объяснение этому заключается в том, что при электрофоретическом определении размеров амплифицированных фрагментов по нелокусному внешнему высокомолекулярному стандарту ДНК pBR322/AluI имеет место системная ошибка. При этом аллель 18 (716 п.н.) может ошибочно определяться как аллель 19 (753 п.н.).
Это объяснение выглядит достаточно убедительным в свете ранее полученных в работе [12] данных, касающихся изучения свойств гетерологичных маркерных систем применительно к фрагментному анализу ДНК, а именно, что определение размеров амплифицированных фрагментов по нелокусным внешним стандартам ДНК как в агарозных, так и в полиакриламидных гелях сложным образом зависит от экспериментальных условий и может быть некорректным в определенных диапазонах длин. Тем не менее прояснение этого вопроса требует отдельных исследований, которые нами сейчас проводятся.
Для проверки соответствия наблюдавшегося распределения генотипов локуса D1S111 в обеих исследованных выборках равновесию Харди-Вайнберга (РХВ) использовалось три различных статистических теста. Надо заметить, что в настоящее время для такого рода проверок используются различные статистические тесты. Однако выявление возможных (особенно – незначительных) отклонений весьма затруднительно при большом числе нулевых или уникальных классов наблюдений, что имеет место и в нашем случае. Для мини- и микро- сателлитных локусов в последнее время стандартной практикой является использование точных (вероятностных) тестов, и в первую очередь критерия Фишера, который в такой ситуации является наиболее мощным среди достоверных критериев [14, 15].
По результатам всех тестов, наблюдавшееся распределение генотипов только для исследованной выборки 1 не отклонялось от РХВ. Для выборки 2 наблюдались определенные отклонения, которые в настоящее время являются предметом дополнительных исследований. Возможно, что эти отклонения, так же как и отмеченный выше дисбаланс численных значений полиморфизма между выборками, обусловлены именно тем, что использованному при исследовании выборки 2 методу идентификации амплифицированных аллелей присуща определенная системная ошибка.
Результаты этих дополнительных исследований будут опубликованы отдельно.
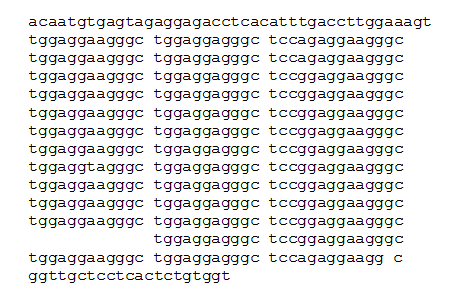
Рис. 1 Фрагмент референтной нуклеотидной последовательности AL359962, ограниченной локализацией использованных праймеров (выделены в рамки). Отдельные повторы длиной 37 н.о., вынесены построчно.
1 2 3 М
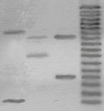
Рис. 2. Электрофореграмма амплифицированных фрагментов ДНК (2,5% агорозный гель, окрашивание этидиумбромидом). Результаты типирования ПДАФ ДНК локуса D1S111 для выборки из 3 неродственных человек, в которой представлены 5 аллельных вариантов, в том числе достаточно редкий вариант 9 (показан стрелкой). M - аллельный маркер локуса D1S111, содержащий аллельные фрагменты с 9 (381 п.н.) до 25 (973 п.н.).
М 1 2 3
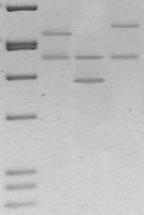
Рис. 3. Электрофореграмма амплифицированных фрагментов ДНК (2,5% агорозный гель, окрашивание этидиумбромидом). Результаты типирования ПДАФ ДНК локуса D1S111для выборки из 3 неродственных человек, в которой представлены 4 аллельных варианта. M – маркер молекулярных масс pBR322/AluI
Таблица 1
Референтные нуклеотидные последовательности для минисателлита D1S111
GenBank, номер доступа | Дата | Определение | Размер и тип последовательности | Размер ПЦР- фрагмента, п.н. |
M30548 | 03-08-1993 | Human minisatellite region detected by myoglobin 33-repeat probe, clone lambda 33.6. | 548 п.н. | 518 |
--- | 1996 | Нуклеотидная последовательность аллеля №14 из работы [5] | 566 п.н. | 566 |
AK128376 | 19-02-2004 | Homo sapiens cDNA FLJ46519 fis, clone THYMU3033649, highly similar to T-cell surface glycoprotein CD3 zeta chain precursor. | 3008 п.н. | 604 |
AL359962 | 22-11-2004 | Human DNA sequence from clone RP11-104L21 on chromosome 1q23.3-25.1. Contains the 3' end of the POU2F1 gene for POU domain class 2 transcription factor 1, the 3' end of the CD3Z gene for CD3Z antigen zeta polypeptide (TiT3 complex) and two CpG islands, complete sequence. | 67173 п.н. | 531 |
Таблица 2
Структура усредненного тандемного повтора минисателлита D1S111
Субповтор | Длина, н.о. | Последовательность |
1 | 12 | tgg agg aag ggc |
2 | 11 | tgg agg agg gc |
3 | 14 | tcc gga gga agg gc |
Tаблица 3
Распределение аллелей локуса D1S111 в двух исследованных выборках.
Аллель |
Размер, п.н. | Выборка 1 | Выборка 2 | ||
Число | Частота | Число | Частота | ||
9 | 383 | 27 | 0,023 | 33 | 0,030 |
10 | 420 | 18 | 0,015 | 11 | 0,010 |
11 | 457 | 5 | 0,004 | 6 | 0,006 |
12 | 494 | 131 | 0,110 | 139 | 0,128 |
13 | 531 | 10 | 0,008 | 6 | 0,006 |
14 | 568 | 11 | 0,009 | 5 | 0,005 |
15 | 605 | 402 | 0,338 | 317 | 0,291 |
16 | 642 | 12 | 0,010 | 15 | 0,014 |
17 | 679 | 22 | 0,019 | 23 | 0,021 |
18 | 716 | 447 | 0,376 | 310 | 0,284 |
19 | 753 | 43 | 0,036 | 149 | 0,137 |
20 | 790 | 10 | 0,008 | 13 | 0,012 |
21 | 827 | 21 | 0,018 | 26 | 0,024 |
22 | 864 | 20 | 0,017 | 24 | 0,022 |
23 | 901 | 3 | 0,003 | 6 | 0,006 |
24 | 938 | 3 | 0,003 | 3 | 0,003 |
25 | 975 | 2 | 0,002 | 4 | 0,004 |
26 | 1012 | 1 | 0,001 | 0 | 0 |
Суммарно | 1188 | 1,000 | 1090 | 1,003 | |
Таблица 4
Распределение наблюдавшихся генотипов локуса D1S111 в двух исследованных популяционных выборках.
Под выделенной серым цветом диагональю таблицы приведено распределение генотипов для выборки 1, над диагональю - распределение генотипов для выборки 2.
Аллели | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 |
9 | 12 |
|
| 2 |
|
| 5 |
| 1 | 8 | 8 |
| 4 | 1 |
|
|
|
10 |
|
|
| 3 |
| 1 | 2 |
|
| 3 |
|
| 2 |
|
|
|
|
11 |
|
|
|
|
|
| 2 | 1 |
| 2 |
|
|
|
| 1 |
|
|
12 | 3 | 4 |
| 99 | 1 | 1 | 43 |
|
| 40 | 16 | 5 | 6 | 2 | 1 |
| 1 |
13 |
| 1 | 1 | 2 | 1� |
| 1 |
|
| 2 | 2 |
|
|
|
|
|
|
14 | 1 |
|
| 1 |
| 1� | 2 | 1 |
|
|
|
|
|
|
|
|
|
15 | 8 | 4 | 1 | 44 | 2 | 2 | 7952 | 1 | 10 | 88 | 38 | 4 | 6 | 7 | 1 | 2 | 1 |
16 |
|
|
|
|
|
| 2 |
| 1 | 1 | 5 | 1 | 1 | 2 | 1 |
|
|
17 | 2 | 1 |
| 4 |
|
| 4 |
|
| 7 | 3 |
|
|
| 1 |
|
|
18 | 7 | 4 | 3 | 43 | 2 | 4 | 144 | 8 | 10 | 9559 | 23 | 2 | 7 | 8 |
|
| 1 |
19 | 2 |
|
| 7 |
|
| 17 |
| 1 | 13 | 024 | 1 |
| 4 |
|
| 1 |
20 |
| 1 |
| 1 |
| 1 | 1 | 1 |
| 2 | 1 | 1� |
|
|
|
|
|
21 | 2 | 1 |
|
|
|
| 6 | 1 |
| 7 | 2 |
|
|
|
|
|
|
22 |
| 2 |
| 3 |
|
| 7 |
|
| 6 |
|
| 1 |
|
|
|
|
23 |
|
|
|
|
|
| 1 |
|
| 1 |
|
|
| 1 |
| 1 |
|
24 |
|
|
| 1 |
|
|
|
|
| 1 |
|
| 1 |
|
|
|
|
25 |
|
|
|
|
|
| 1 |
|
| 1 |
|
|
|
|
|
|
|
26 |
|
|
|
|
|
|
|
|
| 1 |
|
|
|
|
|
|
|
Таблица 5
Значения основных параметров прикладной информативности локуса D1S111 в двух исследованных выборках.
Оценочный параметр | Выборка 1 | Выборка 2 |
Объем выборки, человек | 594 | 545 |
Число выявленных аллелей | 18 (9 – 26) | 17 (9 – 25) |
Число наблюдавшихся генотипов из общего числа возможных, (%) | 66 из 171 (39%) | 65 из 153 (42%) |
Наблюдаемая гетерозиготность | 0,685 | 0,732 |
Ожидаемая гетерозиготность (несмещенная оценка) | 0,729 ± 0,008 | 0,797 ± 0,006 |
Вероятность случайного совпадения генотипов, pM | 0,116 | 0,071 |
Дискриминирующий потенциал | 0,884 | 0,929 |
Потенциал исключения отцовства | 0,406 | 0,480 |
Усредненный индекс отцовства | 1,59 | 1,87 |
Индекс полиморфизма | 0,69 | 0,77 |
похожие статьи
Особенности анализа генотипа лица мужского генетического пола без детекции «Y» при исследовании гена амелогенина / Потеряйкин Е.С., Якубович В.С., Игнатова С.В. // Избранные вопросы судебно-медицинской экспертизы. — Хабаровск, 2019. — №18. — С. 172-174.