Изолирование фторидов из печени деструкцией с последующим определением
/ Лаврешин А.Н., Крылова А.Н. // Судебно-медицинская экспертиза. — М., 1976 — №1. — С. 31-34.

УДК 340.67:546.16
Научно-исследовательский институт судебной медицины (дир. — проф.В. И. Прозоровский) Министерства здравоохранения СССР, Москва
Изолирование фторидов из печени деструкцией с последующим определением. Лаврешин А.Н., Крылова А.Н. Суд.-мед. эксперт., 1976, № 1, с. 31
Разработан метод изолирования фторидов, основанный на одновременной деструкции биологического материала смесью хлорной и серной кислот и отгонке фтористого водорода с водяным паром в замкнутом перегонном аппарате. Затрата времени до 2 ч на одно определение. При добавлении от 0,5 до 10,0 мг фтор-иона к 100 г печени в среднем определяется 88—92% с относительной погрешностью 17,3—6,5% соответственно.
Таблиц 2.
Соединения фтора, обладая высокой токсичностью, неоднократно были объектами судебно-химического исследования. Судебно-химические лаборатории страны не имеют надежного метода анализа органов трупа человека на фториды. Основные работы, посвященные определению фторидов в биологическом материале, относятся к определению их в моче, костях и растениях.
Для изолирования фторидов из биологического материала применяют сухое озоление в присутствии гидроокиси кальция или другого щелочного реагента (М.Д. Швайкова, 1965; Н.С. Николаев и соавт., 1970). Озоление производят в дорогостоящей и малодоступной посуде из платины, оно требует большой затраты времени (1—2 рабочих дня). Для отделения фторидов от мешающих веществ после озоления используют дистилляцию фторидов с водяным паром или диффузию их в виде фтористого водорода.
При судебно-химическом исследовании органов человека на фториды в судебномедицинских лабораториях страны производится лишь их качественное доказательство.
Судебно-химическому исследованию на фториды посвящены единичные работы.
Klewska, Strycharska (1968) при химико-токсикологическом исследовании на фториды использовали озоление биологического материала с избытком гидрата окиси кальция, выделение фторидов из золы отгонкой в виде кремниефтористоводородной кислоты и спектрофотометрическое определение их в дистилляте с циркониевым лаком 2 п-ди-сульфофенилазо-1,8-диоксинафталин-3,6-дисульфокислоты.
Oelschlager (1968) отмечает, что при определении фторидов в биологическом материале наблюдаются значительные ошибки, если озоление вести в муфельных печах, выложенных шамотом, который обычно содержит соединения фтора: при 450° ошибка может достигать 40%, а при 550° — даже 390%. Озоление проб, содержащих малые количества фторидов, он рекомендует проводить в муфельной печи, выстланной платиновой жестью.
Целью нашего исследования были разработка ускоренного метода изолирования фторидов из органов трупа человека и их количественное определение применительно к задачам судебно-химического анализа. Так как со стадией озоления биологического материала связаны ошибки при определении фторидов, мы поставили задачу исключить ее и для разрушения материала применили деструкцию, эффективно использованную ранее при анализах на ртуть (А.Н. Крылова, 1974).
Использовали принцип одновременной деструкции биологического материала и отгонки фтористого водорода с водяным паром в замкнутом перегонном аппарате. Для определения фторидов в дистилляте применили спектрофотометрический метод, основанный на разрушении фторид-ионом окрашенного в красный цвет комплекса циркония с эриохромцианином R (Е.К. Киселева, 1966). Проверили методику определения и модифицировали ее — использовали для работы восходящий график. Закону Бера подчиняются концентрации до 1,2 мкг/мл фторид-иона. Оптическую плотность окрашенного раствора измеряли при 527 нм в кювете с толщиной поглощающего слоя 30 мм.
Объектом исследования была печень, которую брали не позже 1 сут после смерти лиц, получивших травму черепа. В процессе работы печень хранили в холодильнике.
Russel (1970) описал ускоренный метод газохроматографического определения фторидов в печени, крови и моче, основанный на деструкции тканей соляной кислотой и
пергидролом и отгонке фтористого водорода с водяным паром. Методика рассчитана на малые навески (1 г), однако использовать ее в сочетании с последующим колориметрическим определением фторидов в дистилляте по цветной реакции с цирконий-эриохромцианиновым комплексом мы не смогли из-за присутствия в дистилляте окислителей (хлора, кислорода).
Для деструкции материала мы изучили в разных соотношениях смеси кислот: хлорной, азотной и серной. Стремились подобрать такие условия деструкции и отгонки фторидов с водяным паром, которые позволяли бы не загрязнять излишне дистиллят недоразрушенными органическими веществами и обеспечивали бы полноту отгонки фторидов для количеств, обычно содержащихся при отравлениях.
Наилучшие результаты были получены с применением для деструкции 5 г печени смеси кислот, состоящей из 57% хлорной и 80% серной кислот по 20 мл.
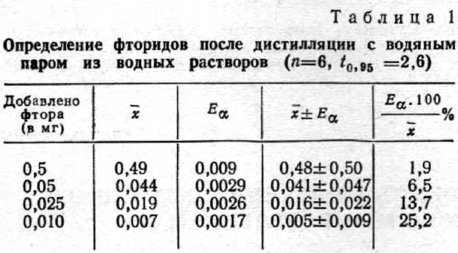
Предварительно изучили полноту отгонки фторидов с водяным паром из водных растворов, содержащих различные количества их, в условиях деструкции ткани. Установили, что для полной отгонкн 0,01—0,5 мг фторидов в пробе необходимо собрать 50— 150 мл дистиллята. Основное количество фторидов при перегонке с водяным паром переходит в первые 50 мл дистиллята (60—85%). Дистиллят собирали в раствор щелочи и самотеком. При этом получены аналогичные результаты.
Результаты определения фторидов приведены в табл. 1.
Дистилляты, полученные при использовании метода одновременной деструкции биологического материала и отгонки фтористого водорода, нередко содержат муть и опалесцируют. При фильтровании через бумажный фильтр опалесценция сохраняется, что приводит к заниженным результатам анализа.
Считая, что опалесценция в дистиллятах обусловлена остатками белков, мы осаждали их соляной кислотой. С этой целью к полученным дистиллятам добавляли соляную кислоту до pH 1,0, через 10 мин осевшие хлопья белков отфильтровывали. Дистилляты в этом случае не имели опалесценции или она была столь слабой, что незначительно влияла на результаты определений фторидов.
Определению фторидов с помощью комплекса циркония с эриохромцианином R мешают сульфаты и фосфаты, которые связывают ионы циркония и многих металлов и образуют прочные комплексы с фторид-ионом. Из указанных веществ с водяным паром не перегоняются сульфаты и соли металлов.
В большинстве методик, описанных в литературе, при отгонке фтористого водорода с водяным паром фосфаты необходимо связывать в нерастворимую соль серебра.
Мы проверили возможность перегонки с водяным паром неорганических фосфатов и фосфатов, входящих в состав тканей. Для этого провели дистилляцию фосфатов с водяным паром: в колбу перегонного аппарата помещали 1 г двузамещенного фосфата натрия, а затем проводили отгонку, добавляя через воронку по 20 мл 57% хлорной и 80% серной кислот. В собранном дистилляте, а также в дистиллятах, полученных после деструкции 5 г печени, определяли фосфаты по реакции образования фосфорномолнбденовой сини. Реакцию проводили следующим образом: к 40 мл дистиллята (при объеме 100 мл дистиллят упаривали до 40 мл) добавляли 1 мл концентрированной серной кислоты, 2 мл 2% раствора молибдата аммония, 2 мл 2% раствора аскорбиновой кислоты и нагревали раствор на кипящей водяной бане в течение 15 мин. При наличии фосфатов должна появиться синяя окраска.
Ни при дистилляции фосфата натрия, ни в дистиллятах, полученных при деструкции печени, фосфатов не обнаружили. Это дало возможность избежать дополнительного комплексирования фосфатов в деструктате и производить отгонку фторидов без добавления дефицитного сульфата серебра.
В результате мы разработали следующую методику изолирования фторидов из печени человека и количественного определения их.
Методика. 5 г тщательно измельченной средней пробы печени переносили в колбу дистилляционного прибора К Колбу устанавливали на предварительно нагретую песчаную баню, соединяли с холодильником и подключали к нагретому парообразователю. Через воронку в колбу добавляли 20 мл 57% хлорной кислоты, затем 20 мл 80% серной кислоты. Собирали 150 мл дистиллята, подкисляли его концентрированной соляной кислотой до pH 1,0 и оставляли на 10 мин. Фильтровали дистиллят через бумажный фильтр в мерную колбу емкостью 200 мл, доводили объем до метки водой и раствор хорошо перемешивали. 50 мл дистиллята переносили в колбу (желательно из кварцевого стекла), доводили раствором едкого натра до pH 7,0, добавляли 5 мл раствора эриохромцианина R1, 5 мл раствора соли циркония2 и раствор перемешивали. Оптическую плотность раствора измеряли при 527 нм в кювете с толщиной поглощающего слоя 30 мм. Для получения восходящего графика в качестве раствора сравнения использовали раствор комплекса циркония ч с эриохромцианином R и измеряли оптическую плотность раствора сравнения по отношению к исследуемому раствору (поменяли местами кюветы при измерении светопоглощения).
По литературным данным (А.О. Войнар, 1953), естественное содержание фторидов в печени человека может достигать 0,64 мг на 100 г органа. Мы определяли естественное содержание фторидов в печени. В пересчете на 100 г печени оно составляло от 0,11 до 0,60 мг фторид-иона. При сохранении печени в холодильнике до 10 дней изменений в содержании фтора не отмечено.
Разработанную методику проверили при исследовании печени человека. В средней пробе печени определяли естественное содержание фтора, затем к 5 г средней пробы печени добавляли определенное количество стандартного раствора фторида натрия и определяли фторид-ион, как описано. Из полученных результатов высчитывали естественно содержащиеся количества фтора. Результаты определения приведены в табл. 2.
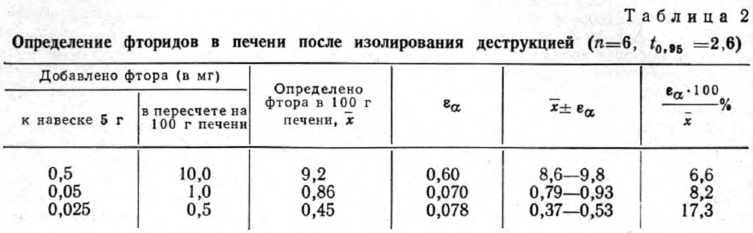
Опыты показали, что при добавлении к печени количеств фторидов, обычно встречающихся при отравлениях, они определяются с достаточной точностью.
Разработанный нами метод изолирования фторидов из биологического материала требует незначительной затраты времени на проведение анализа (до 2 ч) и обладает достаточной точностью, удовлетворяющей задаче химико-токсикологического исследования.
Вывод
Разработан метод изолирования фторидов, основанный на одновременной деструкции биологического материала и отгонке фтористого водорода с водяным паром в замкнутом перегонном аппарате. Затрата времени до 2 ч на одно определение. При добавлении от 0,5 до 10,0 мг фторид-иона к 100 г печени в среднем определяется 88—92% с относительной погрешностью 17,3—6,5% соответственно.
1 1,8 г эриохромцианина R растворяли в небольшом количестве воды и доводили объем водой до 1 л.
2 0,265 г хлорокиси циркония растворяли в 50 мл воды, добавляли 700 мл концентрированной соляной кислоты и разбавляли водой до 1 л.
похожие статьи
К вопросу о химическом распознавании сероуглерода в крови при отравлениях / Кромер Н. // Судебно-медицинская экспертиза. — М.: Изд-во Наркомздрава, 1928. — №8. — С. 42-44.