Определение кодеина в биологическом материале
/ Зимнухов В.В., Кисвянцева Н.М., Никитенко В.Ф., Шандыба О.А. // Судебно-медицинская экспертиза. — М., 1976 — №4. — С. 34-36.

Краснодарское краевое бюро судебно-медицинской экспертизы (нач. В.Т. Анохин)
УДК 340.67:[615.223:547.943
ESTIMATION OF CODEINUM IN BIOLOGICAL MATTER
V. V. Zimnukhov, N. M. Kisvyantseva, V. F. Nikitenko, O. A. Shandyba
The material was purified by paper electrophoresis. Identification of codeinum was carried out by TLC on silicagel and by microcrystalline test with 15 p. c. solution of cadmium iodide. Estimation was executed using extraction and by photometry with methylic orange. Detection and estimation range in liver is 150 mkg/100 g.
При судебно-химическом исследовании биологических объектов для обнаружения кодеина используют реакции окрашивания, чувствительность и доказательность которых зависят от содержания экстрактивных веществ. Методы очистки и определения кодеина изучены недостаточно. Мы поставили задачу разработать соответствующие методики, отвечающие требованиям химико-токсикологического анализа.
Экспериментальная часть. Кодеин из биологического материала извлекали водой, подкисленной щавелевой кислотой до pH 2, и экстрагировали хлороформом при pH 9. Для очистки кодеина от экстрактивных веществ использовали электрофорез на бумаге, который проводили в течение 1 ч при напряжении 400 В на бумаге «Filtrak FN-11» в приборе ПВЭФ-1. Электролит — универсальная буферная смесь из 0,2 М раствора едкого натра и 0,04 М растворов фосфорной, борной и уксусной кислот. Электрофореграммы проявляли модифицированным реактивом Драгендорфа (И.И. Хейс, К. Мацек, 1962). Установили, что наиболее полная очистка кодеина достигается при pH 7 электролита. При этом основная масса экстрактивных веществ остается на старте, а небольшие количества их хотя и мигрируют к катоду, но значительно отстают от кодеина, ДПФ которого в зависимости от содержания экстрактивных веществ колеблется в пределах 8—12 см (до переднего края пятна).
Кодеин с электрофореграмм элюировали по следующей методике. Полоску бумаги, вырезанную с места локализации кодеина, помещали на 10 мин в камеру, насыщенную парами концентрированной соляной кислоты. Затем один конец полоски заостряли, противоположный зажимали между двумя предметными стеклами и помещали в кювету с 1% раствором соляной кислоты. Элюат под действием капиллярных сил поднимался между стеклами и промывал бумагу. Для полного вымывания кодеина с полоски площадью 50 см2 достаточно собрать 0,1—0,3 мл элюата.
Обнаружение кодеина проводили по методике, предложенной А.Ф. Рубцовым и Е.М. Саломатиным для доказательства морфина 1, позволяющей дифференцировать кодеин от других веществ, дающих окрашивания с реактивами Марки и Фреде. Для доказательства выделенного кодеина изучили микрокристаллоскопические реакции. (В.М. Позднякова, 1968) и остановились на реакции с 15% раствором йодида кадмия как наиболее чувствительной и легко воспроизводимой. В ходе реакции образуются сростки из удлиненных бесцветных призм.
Для определения кодеина применили экстракционно-фотометрический метод по реакции с метиловым оранжевым (МО). Определяли субстехиометрическим способом, экстрагентом служил хлороформ. Установили, что этим методом можно определять кодеин как в элюате, так и без предварительного элюирования с электрофореграммы. Во втором случае кодеин в реакцию образования соединения с МО вводят на бумаге с места его локализации. Оптическая плотность хлороформных экстрактов, полученных после введения кодеина в водном растворе и на бумаге, имела одинаковые значения. В контрольных опытах с бумагой FN-11 площадью до 100 см2 оптическая плотность была равна нулю. Учитывая, что определение кодеина без предварительного элюирования позволяет избежать дополнительных потерь и ускорить анализ, этот вариант выбрали для дальнейших исследований.
Методика определения. В делительную воронку вносили 10 мл универсальной буферной смеси с pH 5, 3 мл 0,3% раствора МО2, 10 мл хлороформа и полоску бумаги места локализации кодеина и энергично встряхивали в течение 5 мин. После расслаивания жидкостей хлороформный экстракт переносили в центрифужную пробирку с полиэтиленовой пробкой и центрифугировали 3 мин (3000 об/мин). Оптическую плотность экстракта, окрашенного в желтый цвет, измеряли на фотоэлектроколориметре ФЭК-М, используя в качестве раствора сравнения хлороформ (светофильтр синий, ЯМакс 420 нм, кювета 10 мм, отсчет по левому барабану). Калибровочный график строили в пределах 20—150 мкг, используя раствор кодеина в воде 100 мкг/мл. При этом соблюдался закон Ламберта—Бера.
Соединение с МО при хроматографировании в тонких слоях силикагеля разрушается с выделением свободного кодеина. Это позволяет при низких концентрациях весь выделенный кодеин использовать для количественного определения. Экстракт после измерения оптической плотности хроматографировали и кодеин на хроматограмме доказывали реакциями с реактивами Марки и Фреде.
Исследование трупного материала. 100 г тщательно измельченного объекта заливали 200 мл воды, подкисляли насыщенным раствором щавелевой кислоты до pH 2 по универсальной индикаторной бумаге и настаивали 2 ч при комнатной температуре, частом перемешивании и постоянном pH. Смесь центрифугировали 30 мин при 3000 об/мин, экстрагировали эфиром трижды по 50 мл. Эфирные экстракты отделяли, водную фазу подщелачивали 25% раствором аммиака до pH 9 и экстрагировали хлороформом (40, 30, 30 мл по 5 мин). Экстракты объединяли и фильтровали через сухой фильтр в мерную колбу, объем доводили хлороформом до 100 мл. 10 мл хлороформного экстракта выпаривали досуха, остаток исследовали общеалкалоидными реактивами. При отрицательном результате с общеалкалоидными реактивами или при образовании мути весь экстракт, а при наличии осадков — его аликвоту упаривали до объема около 1 мл и количественно наносили капилляром на стартовую линию бумаги FN-11 шириной 5 и длиной 30 см. Экстракт наносили в виде полосы равномерно на всю ширину бумаги на расстоянии 6 см от анодного конца. Бумагу смачивали электролитом (pH 7) и переносили в камеру, опуская концы ее в ванночки с электролитом. После полного пропитывания бумаги проводили электрофорез при 400 В в течение 1 ч. По окончании электрофореза бумагу высушивали при комнатной температуре. С одного края ее (по длине) отрезали полосу шириной 0,5 см и опрыскивали реактивом Драгендорфа. С непроявленной части, электрофореграммы на уровне окрашенного пятна вырезали полоску, 3/5 части выделенного участка бумаги отрезали (по направлению электрофореза), окуривали парами концентрированной соляной кислоты и кодеин элюировали 1 % раствором соляной кислоты по методике, описанной выше. Собирали 3—5 капель элюата. Каплю элюата смешивали на предметном стекле с каплей 15% раствора кадмия йодида. Кристаллизацию наблюдали в течение 5 ч при хранении во влажной камере. 2—3 капли элюата испаряли при нагревании до 60°. Остаток растворяли в этаноле и наносили в виде точек на 2 пластинки размером 9X12 см с закрепленным слоем силикагеля. В две другие точки наносили по 20 мкг кодеина и морфина, растворенных в этаноле. Проводили хроматографирование в системе: этанол—диоксан—бензол — 25% раствор аммиака (1:8:10:1), длина пути фронта 10 см. Одну пластинку проявляли методом наложения реактивом Марки, другую — реактивом Фреде. Rt выделенного кодеина колебался в пределах 0,2—0,32 и близок к Rt чистого препарата. В делительную воронку вносили 10 мл буферной смеси с pH 5, 3 мл 0,3% раствора МО и полоску бумаги (определенной ширины) с места локализации кодеина. Определение проводили по описанной выше методике.
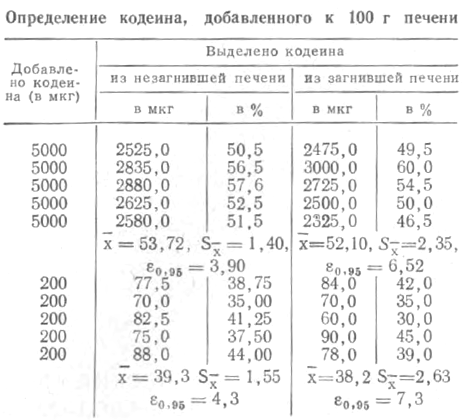
Если после проявления реактивом Драгендорфа получали небольшое слабоокрашенное пятно, то на количественное определение брали весь участок бумаги, вырезанный с непроявленной части электрофореграммы. Для доказательства кодеина хлороформный экстракт после измерения оптической плотности упаривали до объема около 0,5 мл и подвергали хроматографическому исследованию. При отсутствии окрашенного пятна на проявленной электрофореграмме исследование прекращали и делали заключение о ненахождении кодеина. На модельных смесях печени с кодеином изучали разрешающие возможности методики. Опыты проводили как с незагнившей печенью, так и с печенью, находившейся 3 мес при комнатной температуре. К пробам измельченной печени (по 100 г) добавляли определенное количество кодеина и хранили в течение 2 сут при комнатной температуре, а затем исследовали. Результаты представлены в таблице.
Из таблицы видно, что при содержании 200—5000 мкг кодеина из незагнившей печени выделяется в среднем 39,3—53,72%, из загнившей — 38,2—52,1%.
Электрофорез на бумаге позволяет отделять кодеин от соэкстрактивных веществ и создавать благоприятные условия для его доказательства и определения при исследовании как незагнивших, так и гниющих объектов. Граница обнаружения кодеина в 100 г печени хроматографией в тонком слое силикагеля — 150 мкг, хроматографией совместно с реакцией с 15% раствором кадмия йодида — 400 мкг. Граница определения — 150 мкг в 100 г печени. Предложенная методика успешно применена нами в экспертной практике.
В работе не затронуты вопросы метаболизма, сохраняемости и распределения кодеина, так как они нуждаются в специальных исследованиях.
Выводы
- Электрофорез на бумаге позволяет добиться эффективной очистки кодеина от соэкстрактивных веществ. Степень очистки зависит от pH электролита, наиболее полное отделение экстрактивных веществ достигается при pH 7.
- Кодеин, выделенный из биологического материала, может быть надежно доказан хроматографией в тонком слое силикагеля и микро-кристаллоскопической реакцией с 15% раствором йодида кадмия.
- Экстракционно-фотометрическим методом по реакции с метиловым оранжевым можно определять кодеин, выделенный из незагнивших и гниющих объектов.
1«Суд.-мед. экспер.», 1974, № 2, с. 45—48.
2 Реактив готовили по прописи В.И. Малаховой (1970).
похожие статьи
Особенности распределения 2,4- и 2,6-ди-трет-бутилгидроксибензола в организме теплокровных животных / Шорманов В.К., Цацуа Е.П., Асташкина А.П. // Судебно-медицинская экспертиза. — М., 2019. — №1. — С. 36-42.