Способность гетероиммунных сывороток анти-Р выявлять агглютиноген Р в консервированной и неконсервированной крови, сохраняемой в жидком состоянии при разных температурных режимах
/ Мишакова М.В. // Судебно-медицинская экспертиза. — М., 1962 — №4. — С. 33-37.

Научно-исследовательский институт судебной медицины (дир. — В.И. Прозоровский) Министерства здравоохранения СССР
Mishakova, M. V.: The Capacity of Anti-P Heteroimmune Sera for Agglutinogen P Detection in Preserved and Nonpreserved Blood Kept in Fluid Conditions at Various Temperatures
Поступила в редакцию 21/VIII 1961 г.
В судебномедицинской практике приходится исследовать кровь, подвергавшуюся различным внешним воздействиям и имеющую неодинаковую давность хранения. При изготовлении гетероиммунных сывороток анти-Р для их абсорбирования обычно используют консервированную кровь, сохранявшуюся разное время. Поэтому в настоящей работе мы поставили задачу изучить способность иммунных сывороток анти-Р выявлять агглютиноген Р в консервированной и неконсервированной крови, находившейся в различных температурных условиях.
Имеется много работ, посвященных вопросам устойчивости агглютиногенов крови изосерологических систем АВ0, MNSs, резус и влияния на них консервирования крови (В.А. Багдасаров, В.Я. Рубашкин, Н.И. Блинов и Т.Г. Соловьева, Хеттерсли и Фаусет (Hattersley, Fawcett) и др.
Большинство авторов наблюдало снижение агглютинационной способности эритроцитов при хранении консервированной и неконсервированной крови (А.Н. Филатов и Н.С. Линдебаум, Эллиот, Макфарлан и Вохан (Elliot, Macfarlane, Vauchan), Макдональд и Стефен (Macdonald, Stephen).
Вопрос об устойчивости агглютиногена Р в зависимости от совместного действия 3 факторов — консервирования крови, температурного режима и длительности хранения — ни в отечественной, ни в зарубежной литературе не освещен.
В работе Кра (Krah) и Хартера (Harter) имеются некоторые указания о влиянии температурных условий и давности хранения жидкой крови на устойчивость агглютиногена Р. Авторы отмечают, что агглютинабильность эритроцитов группы Р, сохраняемых в собственной плазме в холодильнике, практически не изменяется в течение недели и лишь к концу этого срока наблюдается незначительное ослабление реакции. В эритроцитах же, сохраняющихся в физиологическом растворе хлористого натрия, агглютинабильность снижается очень быстро. Юнгмихель (Jungmichel) в своей работе отмечает, что определение P-фактора крови, смешанной с цитратом или флюоридом, затрудняется при ее хранении. Агглютинабильность эритроцитов значительно снижается. Ильхман-Христ (Ilchmann-Christ) наблюдал снижение агглютинационной способности ферментированных и неферментированных эритроцитов уже на 5—10-й день, причем большее снижение отмечалось в цитратной крови. Других указаний об устойчивости агглютиногена Р в литературных источниках мы не нашли.
В данной работе изучалась способность гетероиммунных сывороток анти-Р выявлять агглютиноген Р в крови жидкой неконсервированной и консервированной наиболее часто употребляемыми консервантами, полученными из Московской городской станции переливания крови.
Кровь для исследования брали из пальца в стерильные пробирки с соответствующим количеством консервирующих сред, указанных в табл. 1. После тщательного смешивания кровь разливали в ампулы. Содержимое каждой ампулы использовали лишь для однократного исследования. Каждый опыт проводили с образцом крови, сохраняемым с консервантами и без них в разных температурных условиях: 1) в рефрижераторе (при температуре от 4 до 8°), 2) при комнатной температуре (от 18 до 28°), 3) в термостате (при 37°).
Примененные консервирующие среды
|
№ рецепта |
Состав |
Объемные соотношения | |
|
консервант |
кровь | ||
|
2 |
Кислый цитрат, 4 г Глюкоза, 10 г Хлористый натрий, 6 г Натрий сульфатиазол, 2 г Бидистиллированная вода до 1000 мл |
1 |
1 |
|
5 |
Кислый цитрат, 3,5 г Глюкоза, 2,5 г Натрий сульфацил (альбацид) 1 г Риванол, 0, 006 г Бидистиллированная вода до 1000 мл |
1 |
9 |
|
7б |
Цитрат дважды кислый, 2 г Глюкоза, 3 г Натрий сульфацил, 0,5 г Левомицетин 0,01 г Бидистиллированная вода, 100 мл |
1 |
4 |
|
8 |
Цитрат натрия кислый (дважды), 3,5 г Сахароза, 80 г Глюкоза, 6 г Натрий сульфацил, 1 г Риванол, 0, 01 г Бидистиллированная вода до 1000 мл |
Кровь берут в консервант «рецепт № 5», плазму удаляют, эритроциты заливают плазмозамещающим раствором, равным по количеству удаленной плазме | |
В опыты вошли 3 серии сывороток, выявляющие не только сильно, но и слабо выраженный агглютиноген Р, и 4 образца крови со слабо (2), умеренно (1) и сильно (1) выраженным агглютиногеном Р. Для того чтобы выяснить, не изменяется ли титр испытуемых сывороток, его определяли свежевзятыми неконсервированными эритроцитами в день первого опыта и в конце исследования, через 5 недель. При исследовании в пределах одного температурного режима применяли одну и ту же серию сыворотки.
Результаты реакции агглютинации учитывали микроскопически после двухчасового стояния смеси сыворотки в соответствующих разведениях с 2% взвесью испытуемых эритроцитов при комнатной температуре и последующего центрифугирования в течение минуты. Продолжительность каждого исследования (в пределах одного температурного режима) ограничивалась 5 неделями.
Устанавливая такой срок, мы исходили из практических соображений. Во-первых, кровь, поступающая к нам из Городской станции переливания крови и служащая для абсорбирования сывороток, имеет давность от нескольких дней до 4 недель; во-вторых, в судебномедицинской практике жидкая кровь, направленная на исследование, из-за большого расстояния может транспортироваться довольно длительное время (до 3—4 недель). Чтобы выяснить, когда начинается снижение агглютинабильности эритроцитов, еженедельно исследовали каждый образец консервированной и неконсервированной крови с испытуемой сывороткой. При заключительном исследовании производили сравнительное определение титра сыворотки с эритроцитами как со свежевзятыми, так и с сохранившимися в течение 5 недель.
В процессе исследования фиксировали явление гемолиза, если он наступал. Результаты проведенной работы представлены в табл. 2.
При хранении крови в рефрижераторе в течение 5 недель агглютинабильность эритроцитов группы Р всегда снижалась.
Однако все же наилучшие результаты исследования были получены при добавлении, к крови консервантов № 2 и 5. Более сильное падение агглютинационной способности наблюдалось при хранении крови в консерванте № 7б и особенно в плазмозамещающем растворе № 8. Следует отметить, что сильно выраженный агглютиноген Р выявлялся в течение 5 недель во всех случаях, даже в неконсервированной крови. Слабо выраженный агглютиноген Р мог быть обнаружен иногда с 3-й (консервант № 7б) и даже со 2-й недели (плазмозамещающий раствор № 8) лишь неразведенной сывороткой анти-Р. Хранение крови в плазмозамещающем растворе № 8 привело к тому, что уже на 5-й неделе только неразведенной сывороткой выявлялся агглютиноген Р в эритроцитах с умеренной силой агглютинабильности.
Наихудшие результаты отмечались всегда при исследовании неконсервированной крови, где в случае низкой первоначальной агглютинационной способности эритроцитов агглютиноген Р на 4—5-й неделе вовсе не обнаруживался, а со 2—3-й недели выявлялся лишь неразведенной сывороткой.
При хранении крови в условиях комнатной температуры в течение 5 недель агглютинабильность эритроцитов группы Р постепенно снижалась, причем в большей степени, чем при сохранении крови в рефрижераторе. Наилучшие результаты были получены с кровью, консервированной растворами № 2, 5 и 7б. Наиболее сильное падение агглютинационной способности эритроцитов наблюдалось в случае добавления к крови плазмозамещающего раствора (№ 8).
Сильно выраженный агглютиноген Р мог быть обнаружен в течение 5 недель во всех случаях. В крови, сохраняемой в плазмозамещающем растворе (№ 8), агглютиноген Р в эритроцитах с умеренной силой агглютинабильности уже на 3-й неделе выявлялся лишь неразведенной сывороткой, а с 4-й недели вовсе не определялся. Слабо выраженный агглютиноген Р мог быть открыт только на 1-й недели и лишь неразведенной сывороткой.
В отношении остальных консервантов (№ 2, 5 и 7б) можно отметить, что слабо выраженный агглютиноген обнаруживался в течение 2 недель в крови одного из доноров и в течение 3 недель — в крови другого при добавлении к крови консервантов № 5 и 7б и на протяжении всех 5 недель в крови первого и 2 недель в крови второго донора при консервировании раствором № 2 (в этом случае фактор Р выявлялся уже со 2—3-й недели только неразведенной сывороткой).
При исследовании неконсервированной крови с 3—4-й недели отмечался полный гемолиз эритроцитов, исключающий возможность осуществить реакцию агглютинации. В случаях с низкой и средней первоначальной агглютинационной способностью эритроцитов агглютиноген Р обнаруживался лишь до 2—3-й недели.
Исследование крови, сохраняемой в термостате в течение 5 недель, показало, что агглютинабильность эритроцитов группы Р значительно снижалась во всех случаях уже с 1-й недели.
Сильно и умеренно выраженный агглютиноген Р выявлялся в консервированной крови в течение 3, а в неконсервированной — в течение 2 недель. Далее наступал полный гемолиз эритроцитов.
В консервированной и неконсервированной крови одного из доноров с низкой первоначальной агглютинационной способностью эритроцитов агглютиноген Р можно было обнаружить в течение 2 недель (причем в одних случаях уже с 1-й недели — консерванты № 5 и 8, в других — консервант № 2 со 2-й) только неразведенной сывороткой анти-Р.
Агглютинабильность этитроцитов группы Р при хранении крови в различных условиях
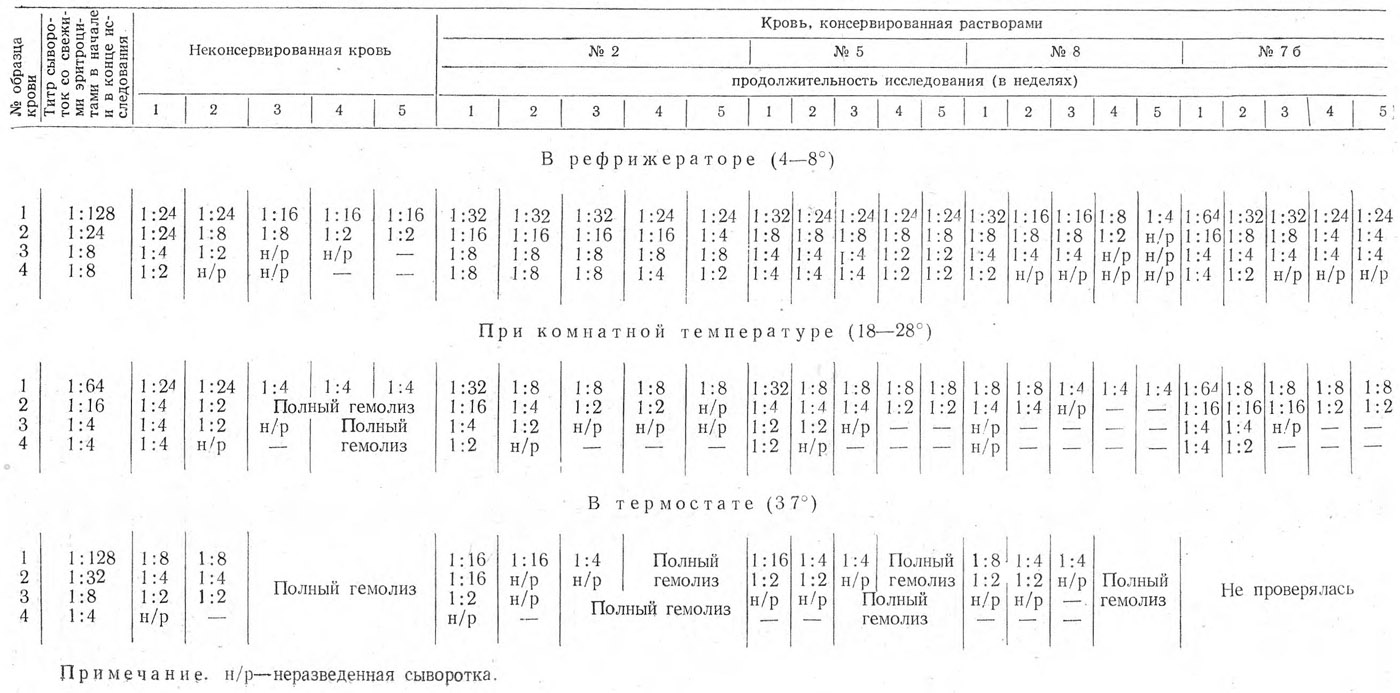
У другого донора с низкой первоначальной агглютинабильностью эритроцитов агглютиноген Р удалось определить лишь на 1-й неделе неразведенной сывороткой в неконсервированной крови и крови, сохраняемой с консервантом № 2. В остальных случаях выявить фактор Р не представилось возможным.
Полученные данные свидетельствуют только об изменении агглютинационной способности эритроцитов в процессе хранения крови в тех или иных условиях, а не о падении титра сывороток анти-Р, так как в течение 5 недель их титр (при установлении свежевзятыми эритроцитами) оставался на одном и том же уровне.
Выводы
- Гетероиммунные сыворотки анти-Р сохраняют свой титр в отношении свежевзятых эритроцитов в течение 5 недель (срок наблюдения).
- Агглютинабильность эритроцитов группы Р всегда снижается при хранении крови в жидком состоянии, причем наибольшее снижение отмечается в отношении эритроцитов, которые содержат слабо выраженный агглютиноген Р: а) наименьшее ослабление агглютинационной способности эритроцитов группы Р наблюдается при хранении крови в рефрижераторе и консервировании ее раствороми № 2 и 5; б) большее снижение агглютинабильности эритроцитов наблюдается при хранении крови в условиях комнатной температуры, особенно в плазмозамещающем растворе № 8; в) к худшим результатам приводит хранение крови при температуре 37°, особенно при консервировании ее растворами № 5 и 8, причем быстро наступает полный гемолиз эритроцитов; г) наименее удовлетворительные данные были получены при сохранении крови в неконсервированном виде.
- Консервирование крови не препятствует выявлению агглютиногена Р, но необходимо подбирать соответствующие консерванты.
- Гетероиммунные сыворотки анти-Р способны обнаруживать агглютиноген Р даже при значительном снижении агглютинабильности эритроцитов в процессе хранения крови в жидком состоянии.
- Для абсорбирования гетероиммунных сывороток анти-Р при их изготовлении целесообразно применять свежую кровь, но можно использовать кровь, сохранявшуюся в рефрижераторе и консервированную растворами № 2, 5 и 7б.
похожие статьи
Определение групповой принадлежности изолированных клеток влагалищного эпителия / Локтева Р.В., Локтев А.И., Шишкина Ж.А., Курзин Л.М. // Избранные вопросы судебно-медицинской экспертизы. — Хабаровск, 2022. — №21. — С. 78-82.
Использование методики окрашивания препаратов раствором акридинового оранжевого при определении групповой принадлежности изолированных клеток с помощью реакции смешанной агглютинации / Локтева Р.В., Королева М.В., Панасенко С.В., Курзин Л.М. // Избранные вопросы судебно-медицинской экспертизы. — Хабаровск, 2022. — №21. — С. 73-78.
Метод избирательной абсорбции при определении кровяных групп в кровяных пятнах / Серебряников П. // Судебно-медицинская экспертиза. — М.: Изд-во Наркомздрава, 1928. — №8. — С. 3-7.
Судебно-медицинские экспертизы и исследования вещественных доказательств биологического происхождения в России (по материалам 2003—2017 гг.) / Ковалев А.В., Куприна Т.А., Самоходская О.В., Кондратова И.В. // Судебно-медицинская экспертиза. — М., 2018. — №6. — С. 29-32.
Обнаружение эклипсных антигенов в трупной крови / Локтева Р.В. // Избранные вопросы судебно-медицинской экспертизы. — Хабаровск, 2019. — №18. — С. 127-131.