Реакция преципитации в агаре как метод дифференцирования белков филогенетически близких видов животных
/ Чарный В.И. // Судебно-медицинская экспертиза. — М., 1964 — №4. — С. 35-38.

Кафедра судебной медицины (нач. — А.Р. Деньковский) Военно-медицинской ордена Ленина академии им. С.М. Кирова, Ленинград
Поступила в редакцию 15/VIII 1964 г.
УДК 340.08:612.1-019-087.9
Реакция специфической преципитации в геле (агаре) получила широкое распространение в иммунологии и в последние годы подверглась экспериментальному изучению с целью внедрения ее в судебно-медицинскую практику.
А.К. Туманов и И.С. Лазуренко, а также А.С. Гаркави считают, что эту реакцию можно использовать в судебной медицине для определения видовой принадлежности крови и белка различных биологических объектов. Основным ее преимуществом является возможность исследования мутных и загрязненных объектов. Она весьма специфична, что, в частности, установлено при исследовании вытяжек из костной ткани, подвергавшейся температурному воздействию.
Возможности применения в судебно-медицинской практике реакции преципитации в агаре не исчерпываются обычным установлением видовой специфичности крови или других белков животного происхождения.
Обычные преципитирующие сыворотки, применяемые в настоящее время при экспертизе пятен крови и других объектов, не являются специфичными только для одного вида животных. Так, например, сыворотка, преципитирующая белок рогатого скота, дает преципитат с белком как крупного рогатого скота (быка), так и мелкого (барана). Чтобы определить, какому именно виду рогатого скота принадлежит кровь на вещественном доказательстве, необходимы специальные сыворотки, преципитирующие белок крупного или мелкого рогатого скота. Однако и эти сыворотки не являются строго специфичными: они позволяют дифференцировать филогенетически близкие виды животных только по скорости наступления реакции. При этом нужно иметь в виду, что эта скорость в значительной степени зависит от концентрации исследуемого белка-антигена. Неточно выбранная концентрация может вызвать серьезные затруднения в оценке результатов реакции.
Для дифференцирования белков животных родственных видов рекомендуют также использовать обычные, но специально подобранные преципитирующие сыворотки. Естественно, что при этом трудности исследования еще более возрастают, и ответ, как правило, может быть лишь предположительным (А.С. Гаркави).
Наши исследования показали, что в судебно-медицинской практике для дифференцирования белков филогенетически близких видов животных можно использовать реакцию преципитации в агаре.
В 1953—1958 гг. Ouchterlony предложил модификацию реакции преципитации в геле, которая позволяет определять спектр антигенов в антигенных комплексах, непосредственно сравнивать 2 антигена, находить в них родственные и неродственные компоненты. Эта методика нашла широкое применение при иммунологическом анализе (Л.А. Зильбер и Г.И. Абелев; В.А. Парнес и др.). Реакцию проводят в плоской пластинке агара, в которой вырезают резервуары для антигенов и преципитирующих сывороток. Антигены и антитела диффундируют в агаре навстречу друг другу. Отдельные компоненты антигена и антисыворотки движутся с различной скоростью. В промежутках между резервуарами антигена и антисыворотки в зоне оптимальной концентрации формируются линии преципитата. Число линий преципитации зависит от спектра антигенного комплекса, выявляемого данной сывороткой, а также от количественного соотношения между антигеном и антителом.
Для сравнения двух систем антигенов в пластинке агара вырезают 3 резервуара, в которые помещают сравниваемые сложные антигены и соответствующую им преципитирующую сыворотку. Если в сравниваемых системах имеются общие компоненты, то их зоны диффузии соединяются и образуют общий фронт, который при встрече с фронтом антител дает дугообразную полосу преципитации (реакции идентичности; рис. 1,а). В случае, когда сравниваемые антигены различны, линии преципитации не сливаются, а перекрещиваются (реакция различия; рис. 1,6). И, наконец, при частичном сходстве антигенов образуется общая дуга преципитации, от которой отходит отросток («шпора»), формирующийся за счет компонента, имеющегося только у одного из двух сравниваемых антигенов (реакция неполной идентичности; рис. I, в).
Реакцию преципитации в агаре обычно проводят в чашках Петри или на стеклах различных размеров. Мы использовали чашки Петри.
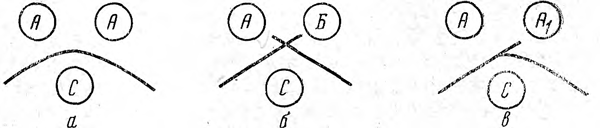
Рис. 1. Виды сравнительной реакции преципитации в агаре.
А, Б., АX — сравниваемые антигены; С — преципитирующая сыворотка, а — реакция идентичности, б — реакция различия, в — реакция неполной идентичности.
Для проведения реакции прежде всего нужно приготовить агаровый гель. Лучшее разделение компонентов исследуемых антигенных комплексов достигается применением 1,5% агара, хотя диффузия в нем происходит несколько медленнее. Берут 3 г агар-агара, заливают дистиллированной водой до 100 мл, разогревают на водяной бане и наливают в ванночку слоем толщиной 1 — 1,5 см. После застывания агар разрезают на небольшие кубики, которые промывают в течение 2 дней проточной водопроводной водой, а затем в течение суток — дистиллированной водой, меняя ее I—6 раз. Воду сливают, агар снова разогревают на водяной бане и добавляют 100 мл 1,7% раствора хлористого натрия.. Горячий агар фильтруют через ватно-марлевый фильтр и разливают в колбочки по 25 — 30 мл. В каждую колбу вносят кристаллик тимола для консервации. Готовый агар можно хранить в холодильнике 4—5 недель.
Перед употреблением агар разогревают па водяной бане и разливают в чашки Петри слоем 4—6 мм. После застывания в нем металлическими пробойниками диаметром 5—8 мм в зависимости от условий опыта по определенному рисунку на бумаге вырезают отверстия в виде треугольника или шестиугольника с дополнительным отверстием в центре. Из отверстий агар удаляют специальной ложечкой или отсасыванием с помощью трубки несколько меньшего диаметра, чем отверстия в агаре. Расстояние между краями отверстий 5—8 мм. На дно их лучше поместить по одной капле расплавленного агара, чтобы реагенты не подтекали под слой геля. Исследуемые антигены и преципитирующую сыворотку заливают по 3—6 капель в отверстия в агаре, и чашки Петри ставят при комнатной температуре в эксикатор с ватой, смоченной водой. Результаты реакции периодически проверяют. Обычно полосы преципитации появляются на следующий день и достигают хорошей выраженности через 2—4 дня. Результаты опытов можно фотографировать с помощью фотоаппарата или, еще проще, контактным путем на особо контрастной бумаге. Для устранения бликов во время фотографирования в чашки Петри рекомендуется наливать небольшое количество воды.
По описанной методике мы провели несколько серий опытов. I серию поставили с кровью коровы и барана и сывороткой, преципитирующей белок рогатого скота. Брали как нативные сыворотки коровы и барана, так и пятна крови (давность до 10 месяцев) этих животных на различных тканях.
Полученные антигенные спектры нативной сыворотки коровы и барана оказались сходными между собой, число линий преципитации зависело от концентрации сывороток. Следует заметить, что преципитирующие сыворотки всегда вводили в неразведенном виде.
С цельными сыворотками коровы и барана образовывалось до 6 линий преципитата. При сравнительном исследовании выяснилось, что все полосы преципитации, образованные сывороткой коровы, сливаются с полосами, возникшими при реакции с сывороткой барана. Однако при слиянии некоторых полос образуются отростки («шпоры») за счет определенных компонентов, имеющихся в одном антигенном комплексе и отсутствующих в другом.
Затем было установлено, что с разведением исследуемых сывороток коровы и барана число полос преципитации уменьшается, а на оставшихся «шпоры» становятся более заметными. Оптимальной концентрацией, при которой наиболее ярко выявляются различия между белками коровы и барана, является разведение сыворотки в 10—100 раз. При этом отчетливо выявляются 2 полосы, на которых при сравнительном исследовании формируются «шпоры».
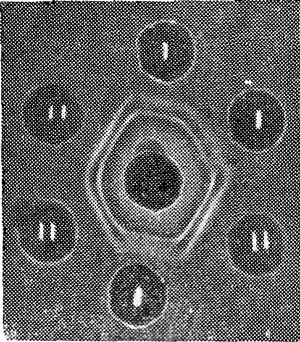
Рис. 2. Контактная фотография реакции преципитации в агаре.
В резервуарах по переферии — вытяжки из пятен крови коровы (/) и барана (//). В центре — сыворотка, преципитирующая белок рогатого скота.
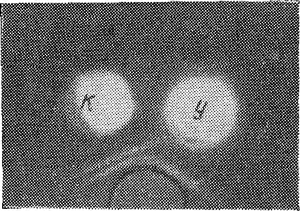
Рис. 3. Контактная фотография реакции преципитации в агаре.
К — вырезка из пятна крови курицы, У — вырезка из пятна крови утки. В третьем резервуаре — сыворотка, преципитирующая белок птицы.
В дальнейшем опыты проводили с вытяжками из пятен крови коровы и барана. Картина была аналогична той, которая наблюдалась в опытах с нативными сыворотками. Это не должно удивлять, так как известно, что гемоглобин не принимает значительного участия в реакции преципитации, идущей главным образом за счет сывороточных белков; последние хорошо сохраняются при высушивании.
Таким образом, нам удавалось четко дифференцировать белки коровы и барана в пятнах крови давностью до 10 месяцев (рис. 2). Опытов с более «старыми» пятнами не проводили.
II серию опытов проводили с вытяжками из пятен крови курицы, индюка и утки и сывороткой, прецепитирующей белок птицы. Разведенные до желто-коричневого цвета (приблизительно в 10 — 100 раз) вытяжки из пятен крови курицы и индюка образовывали с преципитирующей сывороткой по 2 основные линии преципитации. То же наблюдалось и тогда, когда в резервуары в агаре помещали непосредственно вырезки из пятен размером приблизительно 0,25 см' 2 , которые заливали несколькими каплями физиологического раствора. При сравнительном исследовании пятен крови курицы и индюка можно было наблюдать типичную реакцию неполной идентичности: «шпора» образовывалась на линии преципитации, расположенной ближе к резервуарам с антигенами, за счет компонента антигена, имеющегося в крови курицы и отсутствующего в крови индюка.
Еще более резкая разница установлена между антигенным составом белков крови курицы и утки. В опытах с кровью утки при тех же условиях образовывалась только одна практически заметная полоса преципитации, соответствующая одной из двух полос, образуемых белками крови курицы и индюка (рис. 3). При постановке же реакции с сильно концентрированной вытяжкой из пятна крови утки формировалась и вторая полоса преципитации, но в этом случае при сравнительном исследовании с вытяжкой из пятна крови курицы образовывалась отчетливо заметная «шпора».
При сравнительном исследовании пятен крови индюка и утки также образуется «шпора», но менее выраженная, чем при сравнительном исследовании крови курицы и индюка или курицы и утки. Это свидетельствует о том, что в применяемой в опыте преципитирующей сыворотке содержится недостаточное количество антител, необходимых для дифференцирования белков индюка и утки. Из этого можно сделать вывод, что для сравнительного исследования антигенов желательно иметь преципитирующие сыворотки с более широким спектром антител, т. е. менее специфичные в обычном нашем понимании.
Так как число преципитирующих полос и их интенсивность зависят от концентрации антигена, то при сравнительном исследовании желательно, чтобы сравниваемые вытяжки из пятен крови имели приблизительно одинаковую концентрацию белков. Учитывая простоту методики, опыты целесообразно ставить параллельно с различными разведениями вытяжек из пятен.
Выводы
- Реакция преципитации в агаре является простым и объективным методом, позволяющим дифференцировать белки филогенетически близких видов животных.
- При помощи этой реакции удалось четко дифференцировать пятна крови крупного и мелкого рогатого скота, а также пятна крови различных видов домашней птицы с применением обычных преципитирующих сывороток.
похожие статьи
Определение групповой принадлежности изолированных клеток влагалищного эпителия / Локтева Р.В., Локтев А.И., Шишкина Ж.А., Курзин Л.М. // Избранные вопросы судебно-медицинской экспертизы. — Хабаровск, 2022. — №21. — С. 78-82.
Использование методики окрашивания препаратов раствором акридинового оранжевого при определении групповой принадлежности изолированных клеток с помощью реакции смешанной агглютинации / Локтева Р.В., Королева М.В., Панасенко С.В., Курзин Л.М. // Избранные вопросы судебно-медицинской экспертизы. — Хабаровск, 2022. — №21. — С. 73-78.
Метод избирательной абсорбции при определении кровяных групп в кровяных пятнах / Серебряников П. // Судебно-медицинская экспертиза. — М.: Изд-во Наркомздрава, 1928. — №8. — С. 3-7.
Судебно-медицинские экспертизы и исследования вещественных доказательств биологического происхождения в России (по материалам 2003—2017 гг.) / Ковалев А.В., Куприна Т.А., Самоходская О.В., Кондратова И.В. // Судебно-медицинская экспертиза. — М., 2018. — №6. — С. 29-32.
Обнаружение эклипсных антигенов в трупной крови / Локтева Р.В. // Избранные вопросы судебно-медицинской экспертизы. — Хабаровск, 2019. — №18. — С. 127-131.